题目内容
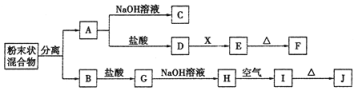
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。提示:黄緑色气体乙是氯气。

请回答下列问题:
(1)写出下列物质的化学式:B______,丙______,H______。
(2)根据要求回答:
①D溶液和F溶液在空气中混合的现象:_______;
②反应③离子方程式________;
③反应⑦离子方程式________;
④反应⑥化学方程式________。
【答案】Al HCl Fe(OH)2 产生白色沉淀迅速变成灰绿色,最后变为红褐色 2Al+2OH-+2H2O=2AlO2-+3H2↑ 2Fe2++2Cl2=2Cl-+2Fe3+ 4Fe(OH)2+ O2+2H2O=4Fe(OH)3
【解析】
金属单质A焰色反应为黄色证明为A是Na,与水反应生成气体甲为H2,物质D为NaOH;金属B和氢氧化钠溶液反应,说明B为Al,黄绿色气体乙为Cl2,气体甲和氯气反应生成丙为HCl,物质E为盐酸,物质D是氢氧化钠,D和物质G为反应H在空气中生成红褐色沉淀I为Fe(OH)3,则H是Fe(OH)2,Fe(OH)3与盐酸发生产生的G为FeCl3,物质F为FeCl2,可判断C为Fe,以此解答该题。
由以上推断可知A是Na,B是Al,C是Fe,D是NaOH,E是盐酸,F是FeCl2,G是FeCl3,H是Fe(OH)2,I是Fe(OH)3。
(1)根据上述分析可知B为Al,丙为HCl,H为Fe(OH)2;
(2)①D是NaOH,F是FeCl2,二者发生复分解反应生成氢氧化亚铁白色沉淀,氢氧化亚铁不稳定,易被空气中的氧气氧化生成红褐色的氢氧化铁沉淀,因此在空气中混合的现象为:产生白色沉淀,白色沉淀迅速变成灰绿色,最后变为红褐色;
②反应③是Al与NaOH溶液反应产生NaAlO2和氢气,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
③FeCl2具有还原性,Cl2具有强的氧化性,二者发生氧化还原反应产生FeCl3,所以反应⑦离子方程式为2Fe2++2Cl2=2Cl-+2Fe3+;
④Fe(OH)2不稳定,容易被氧气氧化产生Fe(OH)3,所以反应⑥化学方程式为4Fe(OH)2+ O2+2H2O=4Fe(OH)3。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案【题目】下列有关实验的操作正确的是
实验目的 | 实验操作 | |
A | 配制浓度为0.010 | 用托盘天平称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
B | 浓盐酸与MnO2反应制备纯净Cl2 | 气体产物先通过浓硫酸,后通过饱和食盐水 |
C | 配制稀硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
D | 排水法收集KMnO4分解产生的O2 | 先移出导管,后熄灭酒精灯 |
A.AB.BC.CD.D