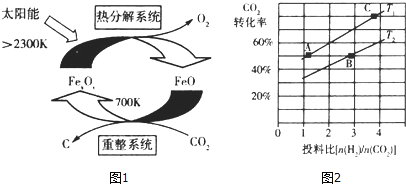
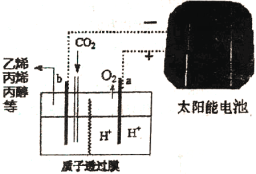
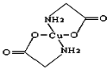
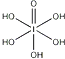
��Ŀ����
����Ŀ���ܣ�Co�����仯�����ڹ�ҵ���й㷺Ӧ�á�Ϊ��ij��ҵ�����л����ܣ�ijѧ������������£������к���Al��Li��Co2O3��Fe2O3�����ʣ���

��֪���������ܽ��ԣ�LiF������ˮ��Li2CO3����ˮ��
�ڲ��ֽ��������γ��������������pH���±���
�� | Fe3+ | Co2+ | Co3+ | Al3+ |
pH����ʼ������ | 1.9 | 7.15 | -0.23 | 3.4 |
pH����ȫ������ | 3.2 | 9.15 | 1.09 | 4.7 |
��ش�
��1��������еõ�������Һ�ķ�Ӧ�����ӷ���ʽ ��
��2���������Co2O3�����ᷴӦ�����ӷ���ʽ ��
��3���������Na2CO3��Һ�������ǵ�����Һ��pH��Ӧ������Һ��pH��Χ�� �������е���Ҫ�ɷ�Ϊ ��
��4���������NaF����ķ�Ӧ�Բ���������������
��5���ڿ����м���5.49 g�����ܾ��壨CoC2O4��2H2O����Ʒ��[M(CoC2O4��2H2O) = 183 g/mol ] ���ȹ����в�ͬ�¶ȷ�Χ�ڷֱ�õ�һ�ֹ������ʣ����������±���
�¶ȷ�Χ/�� | ��������/ g |
150~210 | 4.41 |
290~320 | 2.41 |
890~920 | 2.25 |
���ⶨ��210~290������в���������ֻ��CO2���˹��̷�����Ӧ�Ļ�ѧ����ʽ��
���𰸡���1��2Al + 2OH-+ 2H2O = 2AlO2��+ 3H2��
��2��Co2O3 + 6H+ + 2Cl- = 2Co2++ Cl2��+ 3H2O
��3��3.2-7.15��Fe(OH)3��LiF
��4��������Һ��Li+Ũ�������ⲽ�����в���Li2CO3������
��5��3CoC2O4+ 2O2![]() ��Co3O4+ 6CO2
��Co3O4+ 6CO2
��������
�����������1��������еõ�������Һ����������������Һ��Ӧ����ƫ�����ƺ���������Ӧ�Ļ�ѧ����ʽΪ2Al + 2OH-+ 2H2O = 2AlO2��+ 3H2����
��2������������������Һ���Ȼ���Ϊ���������ԭ���غ�͵����غ������ƽ��д���ӷ���ʽ����Ԫ�ػ��ϼ۽���Ϊ+2�ۣ���Ԫ�ػ��ϼ�-1�۱仯Ϊ0�ۣ���Ӧ�����ӷ���ʽCo2O3 + 6H+ + 2Cl- = 2Co2++ Cl2��+ 3H2O��
��3����������ͼ��֪��������м�Na2CO3��Һ�������ǵ�����Һ��pH�����������ӣ������ܳ��������ӣ����ݱ������ݷ����жϵ�����Һ��pH��Χ��3.2��7.15������̼������Һ����pHֵ��ʹFe3��ת��ΪFe(OH)3������NaF��ʹLi��ת��ΪLiF���������������е���Ҫ�ɷ���Fe(OH)3��LiF��
��4��NaF����Һ�е�Li+�γ�LiF�������˷�Ӧ�Բ���������������������Һ��Li+Ũ�ȣ����ⲽ����в���Li2CO3������
��5�����㾧�����ʵ���n=5.49g��183g/mol=0.03mol��ʧȥ�ᾧˮӦΪ0.06mol�����������仯=0.06mol��18g/mol=1.08g��ͼ�����ݿ�֪��150��210���������仯=5.49g=4.41g=1.08g��˵��210��Cʧȥ�ᾧˮ�õ�CoC2O4��210��290���������CoC2O4�����ķ�Ӧ������������ֻ��CO2������Ԫ���غ�õ�����CO2���ʵ���Ϊ0.06mol������=0.06mol��44g/mol=2.64g�������������Ƽ�С=4.41g-2.41g =2g��˵��˵��������μӷ�Ӧ��������ӦΪ��������Ӧ������������=2.64g-2g=0.64g��O2���ʵ���=0.64g��32g/mol=0.02mol��n��CoC2O4����n��O2����n��CO2��=0.03��0.02��0.06=3��2��6������ԭ���غ���ƽ��д��Ӧ�Ļ�ѧ����ʽΪ3CoC2O4+ 2O2![]() ��Co3O4+ 6CO2��
��Co3O4+ 6CO2��

 ��У��������ĩ��̾�ϵ�д�
��У��������ĩ��̾�ϵ�д�