题目内容
1.某同学设计实验制备2-羟基-4-苯基丁酸乙酯,反应原理、装置和数据如下: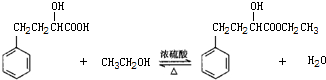
| 相对分子量 | 密度(g/cm3) | 沸点(℃) | 水溶性 | |
| 2-羟基-4-苯基丁酸 | 180 | 1.219 | 357 | 微溶 |
| 乙 醇 | 46 | 0.789 | 78.4 | 易溶 |
| 2-羟基-4-苯基丁酸乙酯 | 208 | 1.075 | 212 | 难溶 |
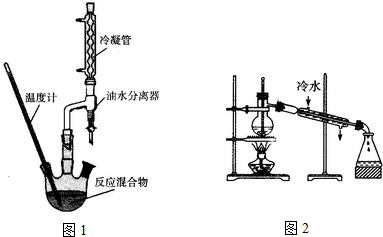
①如图1,在干燥的圆底烧瓶中加入20mL 2-羟基-4-苯基丁酸、20mL无水乙醇和适量浓硫酸,再加入几粒沸石;
②加热至70℃左右保持恒温半小时;
③分离、提纯三颈瓶中的粗产品,得到有机粗产品;
④精制产品.
请回答下列问题:
(1)油水分离器的作用为及时分离产物水,促进平衡向生成酯的反应方向移动
(2)本实验采用水浴加热,因为温度过高会使产率减小(填“增大”、“”减小”或“不变”)
(3)取三颈烧瓶中的混合物分别用水、饱和碳酸氢钠溶液和水洗涤.第二次水洗的目的是洗掉碳酸氢钠
(4)在精制产品时,加入无水MgSO4的作用为干燥;然后过滤,再利用如图2装置进行蒸馏纯化,图2装置中的错误有温度计水银球的位置,冷凝水的方向
(5)若按纠正后的操作进行蒸馏纯化,并收集212℃的馏分,得2-羟基-4-苯基丁酸乙酯约9.0g.则该实验的产率为32%.
分析 (1)2-羟基-4-苯基丁酸于三颈瓶中,加入适量浓硫酸和20mL无水乙醇发生的是酯化反应,存在化学平衡,油水分离器的作用及时分离生成的水,促进平衡正向进行分析;
(2)温度过高,乙醇易挥发,会导致产率下降;
(3)取三颈烧瓶中的混合物分别用水、饱和碳酸氢钠溶液洗涤后,混合物中有少量的碳酸氢钠溶液要除去;
(4)在精制产品时,加入无水MgSO4,硫酸镁能吸水,在蒸馏装置中温度计的水银球的位置应与蒸馏烧瓶的支管口处相平齐,为有较好的冷却效果,冷凝水应采用逆流的方法;
(5)20mL 2-羟基-4-苯基丁酸的物质的量为$\frac{20×1.219}{180}$mol=0.135mol,20mL无水乙醇的物质的量为$\frac{20×0.789}{46}$mol=0.343mol,根据方程式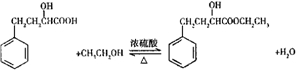 可知,乙醇过量,所以理论上产生2-羟基-4-苯基丁酸乙酯的质量为0.135mol×208g/mol=28.08g,根据产率=$\frac{实际产量}{理论产量}$×100%计算.
可知,乙醇过量,所以理论上产生2-羟基-4-苯基丁酸乙酯的质量为0.135mol×208g/mol=28.08g,根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)原料加入依据先加入密度小的再加入密度大的液体,所以浓硫酸应最后加入,防止浓硫酸使有机物脱水,被氧化等副反应发生,防止乙醇和酸在浓硫酸溶解过程中放热而挥发;2-羟基-4-苯基丁酸于三颈瓶中,加入适量浓硫酸和20mL无水乙醇发生的是酯化反应,存在化学平衡,油水分离器的作用及时分离生成的水,促进平衡正向进行分析,
故答案为:及时分离产物水,促进平衡向生成酯的反应方向移动;
(2)如果温度过高,乙醇易挥发,制备产率会减小,
故答案为:减小;
(3)取三颈烧瓶中的混合物分别用水、饱和碳酸氢钠溶液洗涤后,混合物中有少量的碳酸氢钠溶液要除去,所以要用水洗,
故答案为:洗掉碳酸氢钠;
(4)在精制产品时,加入无水MgSO4,硫酸镁能吸水,在蒸馏装置中温度计的水银球的位置应与蒸馏烧瓶的支管口处相平齐,为有较好的冷却效果,冷凝水应采用逆流的方法,所以装置中两处错误为温度计水银球的位置,冷凝水的方向,
故答案为:干燥;温度计水银球的位置,冷凝水的方向;
(5)20mL 2-羟基-4-苯基丁酸的物质的量为$\frac{20×1.219}{180}$mol=0.135mol,20mL无水乙醇的物质的量为$\frac{20×0.789}{46}$mol=0.343mol,根据方程式 可知,乙醇过量,所以理论上产生2-羟基-4-苯基丁酸乙酯的质量为0.135mol×208g/mol=28.08g,所以产率=$\frac{实际产量}{理论产量}$×100%=$\frac{9.0}{28.08}$×100%=32%,
可知,乙醇过量,所以理论上产生2-羟基-4-苯基丁酸乙酯的质量为0.135mol×208g/mol=28.08g,所以产率=$\frac{实际产量}{理论产量}$×100%=$\frac{9.0}{28.08}$×100%=32%,
故答案为:32%.
点评 本题考查了有机物的实验制备装置分析及原理应用,主要是酯化反应原理和实验过程的分析判断,掌握原理和基础是关键,题目难度中等.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案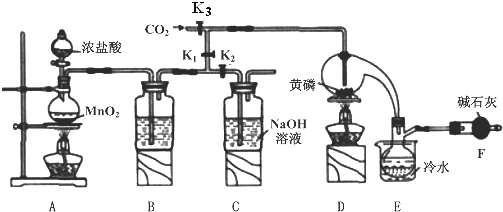
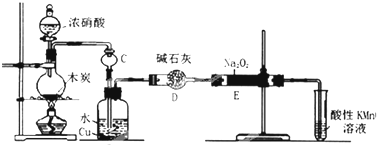
已知:
①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;
②PCl3遇水会强烈水解生成H3PO3和HC1;
③PCl3遇O2会生成POCl3,POCl3溶于PCl3;
④PCl3、POCl3的熔沸点见表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)A装置中制氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B中所装试剂是浓硫酸,F中碱石灰的作用有两种,分别是吸收多余的氯气、防止空气中的H2O进入烧瓶和PCl3 反应.
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃.
(4)粗产品中常含有POCl3、PCl5等,加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O.
(6)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3溶液滴定;
④重复②、③操作平均消耗Na2S2O3溶液8.40mL.
已知:H3PO3+H2O+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,假设测定过程中没有其他反应.根据上述数据,该产品中PC13的质量分数为79.75%.
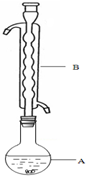 Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)步骤如下:
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)步骤如下:①称取12.6g Na2SO3于烧杯中,溶于80.0mL水.
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中.
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤.
④滤液在经过蒸发浓缩、冷却结晶后析出Na2S2O3•5H2O晶体.
⑤进行减压过滤并干燥.
(1)仪器B的名称是球形冷凝管.其作用是冷凝回流.加入的硫粉用乙醇润湿的目的是增加反应物接触面积,提高反应速率.
(2)步骤④应采取的操作是蒸发浓缩、冷却结晶.
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是Na2SO4.如果滤液中该杂质的含量不很低,其检测的方法是:取出少许溶液,加稀盐酸至酸性,静置后,取上层清液或过滤除去S,再加BaCl2溶液,若出现浑浊则含Na2SO4,反之不含.
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25,00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用酸式(填“酸式”或“碱式”)滴定管来滴定(2S2O32-+I2=S4O62-+2I-),滴定结果如下:
| 滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
| 第一次 | 0.30 | 31.12 |
| 第二次 | 0.36 | 31.56 |
| 第三次 | 1.10 | 31.88 |
I.水体的净化和污水的处理与铁及其化合物密切相关.
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质.简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理FeO42-有强的氧化性,能杀菌消毒,本身被还原为Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质,达到净水的目的.
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:
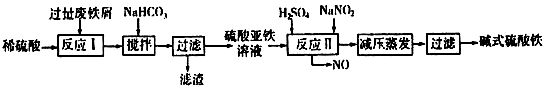
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
①写出反应I中发生的氧化还原反应的离子方程式Fe+2H+═Fe2++H2↑.
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为4.4~7.5.
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为69g.
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子.该水解反应的离子方程式为2[Fe(OH)]2++2H2O?[Fe2(OH)4]2++2H+;.
II.铁的化合物也是制备高能锂电池的重要原料.已知磷酸亚铁锂电池总反应为:
FePO4+Li$?_{充电}^{放电}$LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式LiFePO4-e-═FePO4+Li+.常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为14.(忽略溶液的体积变化).
流程图如图:
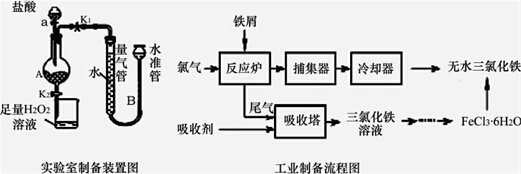
已知:(1)无水FeCl3的熔点为555K、沸点为588K.(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
Ⅰ.打开弹簧夹K1,关闭活塞K2,并打开活塞a,缓慢滴加盐酸.
Ⅱ.当…时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a.
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3•6H2O晶体.请回答:
(1)烧杯中足量的H2O2溶液的作用是把亚铁离子全部氧化成三价铁离子.
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“…”的内容是装置A中不产生气泡或量气管和水准管液面不变(其他合理答案也给分).
(3)从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:加入盐酸后、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式:2Fe2++Cl2=2Fe3++2Cl-.
(5)捕集器温度超过673K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为Fe2Cl6.
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol•L-1Na2S2O3溶液滴定,消耗VmL(已知:I2+2S2O32-═2I-+S4O62-).
①滴定终点的现象是:溶液由蓝色变无色,且半分钟内不变色;
②样品中氯化铁的质量分数$\frac{162.5cV}{m}$%.
| A. | 臭氧空洞、温室效应、光化学烟雾、硝酸型酸雨的形成都与氮氧化合物有关 | |
| B. | 研制出性能优良的催化剂可使反应的温度降低,提高反应速率,从而起到很好的节能效果 | |
| C. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下△H 不同 | |
| D. | 光分解水制氢气、植物秸秆制沼气、高粱制乙醇都涉及到生物质能的利用 |

 溶液出现蓝色且30s内不褪色
溶液出现蓝色且30s内不褪色