题目内容
16.在一定温度下,不能做为反应A2(g)+B2(g)?2AB(g)达到平衡的判断标志是( )| A. | 单位时间内生成n mol A2的同时消耗n mol A2 | |
| B. | 容器内的各组分的浓度不随时间变化而变化 | |
| C. | 单位时间内生成2n mol AB的同时生成n mol B2 | |
| D. | A2、B2和AB的分子数之比为1:1:2 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、单位时间内生成n mol A2的同时消耗n mol A2,正逆反应速率相等,达平衡状态,故A不选;
B、容器内的各组分的浓度不随时间变化而变化说明达平衡状态,故B不选;
C、单位时间内生成2n mol AB等效于消耗n mol B2,同时又生成n mol B2,正逆反应速率相等,达平衡状态,故C不选;
D、当体系达平衡状态时,A2、B2和AB的分子数之比可能为1:1:2,也可能不是1:1:2,与各物质的初始浓度及转化率有关,故D选;
故选D.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
6.下列有机物命名正确的是( )
| A. | 2-乙基丁烷 | B. | 2,2-二甲基-3-戊烯 | ||
| C. | 2,2-二甲基乙醇 | D. | 1,1,2,2-四溴乙烷 |
4.某铝热剂由铁红和铝组成.取a g该铝热剂样品,向其中加入足量的NaOH溶液,测得生成气体的体积为V1 L(标准状况,下同).
另取a g该样品将其引燃,恰好完全反应,待反应产物冷却后,加入足量稀盐酸,测得生成气体的体积为V2 L.若不考虑空气中O2的影响,则V1:V2为( )
另取a g该样品将其引燃,恰好完全反应,待反应产物冷却后,加入足量稀盐酸,测得生成气体的体积为V2 L.若不考虑空气中O2的影响,则V1:V2为( )
| A. | 3:2 | B. | 4:3 | C. | 1:1 | D. | 8:9 |
1.某学习小组做了如下实验探究海带中碘元素的存在形式,并测定其中碘元素的含量.
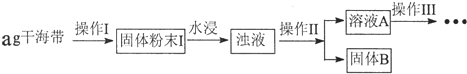
(1)操作Ⅰ为灼烧,则灼烧时应该用坩埚(仪器名称)盛装海带,操作Ⅱ为过滤;
(2)水浸时通常要将悬浊液煮沸2-3min,目的是加快含碘物质在水中的溶解,以使灰烬中的含碘物质尽可能多的进入溶液.
(3)操作Ⅲ,是同学们对溶液A中碘元素的存在形式进行的探究实验.
[推测]:①以IO3-形式存在; ②以I-形式存在
[查阅资料]:IO3-具有较强的氧化性;I2+2S2O32-═2I-+S4O62-将上述溶液稀释配制成200mL溶液,请完成下列实验探究.
限选试剂:3%H2O2溶液、KSCN溶液、FeCl2溶液、稀硫酸
(4)定量检验海带中的碘含量:
①取20mL稀释后溶液A分别于锥形瓶,分别用酸式滴定管滴加0.01mol/LKMnO4溶液至溶液刚显浅红色,将I-氧化为I2并得到溶液B;
②在溶液B加入2滴淀粉溶液,用0.01mol/L Na2S2O3溶液,滴定至终点,终点现象为溶液蓝色刚好褪去,30s内不恢复蓝色,记录数据,重复上测定步骤①、②两次,三次平均消耗Na2S2O3溶液体积为VmL,海带中碘元素的百分含量为$\frac{1.27v}{a}%$.假设操作Ⅰ、Ⅱ中碘不损失,原子量I-127)

(1)操作Ⅰ为灼烧,则灼烧时应该用坩埚(仪器名称)盛装海带,操作Ⅱ为过滤;
(2)水浸时通常要将悬浊液煮沸2-3min,目的是加快含碘物质在水中的溶解,以使灰烬中的含碘物质尽可能多的进入溶液.
(3)操作Ⅲ,是同学们对溶液A中碘元素的存在形式进行的探究实验.
[推测]:①以IO3-形式存在; ②以I-形式存在
[查阅资料]:IO3-具有较强的氧化性;I2+2S2O32-═2I-+S4O62-将上述溶液稀释配制成200mL溶液,请完成下列实验探究.
限选试剂:3%H2O2溶液、KSCN溶液、FeCl2溶液、稀硫酸
| 序号 | 实验操作 | 实验现象 | 结论 |
| ① | 取少量稀释后的溶液A加入淀粉后再用硫酸酸化,分装于试管Ⅰ、Ⅱ | 无现象 | |
| ② | 往试管I中加入FeCl2溶液,后加入2滴KSCN溶液并振荡; | 无现象 | 证明不是以IO3-形式存在 |
| ③ | 往试管II中加入3%H2O2溶液并振荡 | 溶液变蓝 | 证明以I-形式存在 |
①取20mL稀释后溶液A分别于锥形瓶,分别用酸式滴定管滴加0.01mol/LKMnO4溶液至溶液刚显浅红色,将I-氧化为I2并得到溶液B;
②在溶液B加入2滴淀粉溶液,用0.01mol/L Na2S2O3溶液,滴定至终点,终点现象为溶液蓝色刚好褪去,30s内不恢复蓝色,记录数据,重复上测定步骤①、②两次,三次平均消耗Na2S2O3溶液体积为VmL,海带中碘元素的百分含量为$\frac{1.27v}{a}%$.假设操作Ⅰ、Ⅱ中碘不损失,原子量I-127)
8.下列物质中,既含离子键、又含非极性共价键的是( )
| A. | NaOH | B. | Na2O2 | C. | NH4Cl | D. | Na2O |
5.常温下,体积相同、pH也相同的HCl、HNO3、CH3COOH溶液分别与足量的NaHCO3溶液反应,产生CO2的体积( )
| A. | 同样多 | B. | HCl最多 | C. | HCl、HNO3一样多 | D. | CH3COOH最少 |
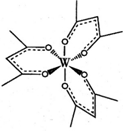 现有原子序数小于36的X、Y、Z、W四种元素.其中X元素的一种核素核内无中子;Y是地壳中含量最多的金属元素;Z原子的质量数为12,质子数与中子数相等;W的基态原子核外3d轨道上的电子数是最外层电子数的3倍.请回答下列问题:
现有原子序数小于36的X、Y、Z、W四种元素.其中X元素的一种核素核内无中子;Y是地壳中含量最多的金属元素;Z原子的质量数为12,质子数与中子数相等;W的基态原子核外3d轨道上的电子数是最外层电子数的3倍.请回答下列问题:
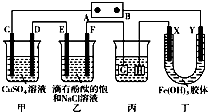 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答下列问题:
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答下列问题: