题目内容
9.在强酸性或强碱性溶液中都能大量共存的一组离子是( )| A. | Ba2+、Fe3+、Cl-、NO3- | B. | Na+、Ca2+、HCO3-、NO3- | ||
| C. | Al3+、NH4+、SO42-、Na+ | D. | Na+、K+、NO3-、SO42- |
分析 强酸性或强碱性溶液中分别存在大量氢离子或氢氧根离子,
A.铁离子与氢氧根离子反应;
B.碳酸氢根离子既能够与氢离子,也能够与氢氧根离子反应;
C.铝离子、铵根离子与氢氧根离子反应;
D.四种离子之间不反应,都不与氢离子和氢氧根离子反应,能够共存.
解答 解:A.Fe3+强碱性溶液中的氢氧根离子反应,在碱性溶液中能够大量共存,故A错误;
B.HCO3-能够与氢离子和氢氧根离子反应,在溶液中一定不能大量共存,故B错误;
C.Al3+、NH4+与强碱性溶液中的氢氧根离子反应,在溶液中不能大量共存,故C错误;
D.Na+、K+、NO3-、SO42-之间不发生反应,都不与强酸性和强碱性溶液反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的正误判断,为高考中的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识的能力.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
19.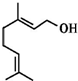 香叶醇是合成玫瑰香油的主要原料,其结构简式如图所示.下列有关香叶醇的叙述正确的是( )
香叶醇是合成玫瑰香油的主要原料,其结构简式如图所示.下列有关香叶醇的叙述正确的是( )
 香叶醇是合成玫瑰香油的主要原料,其结构简式如图所示.下列有关香叶醇的叙述正确的是( )
香叶醇是合成玫瑰香油的主要原料,其结构简式如图所示.下列有关香叶醇的叙述正确的是( )| A. | 不能使溴的四氯化碳溶液褪色 | B. | 香叶醇的分子式为C10H18O | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 能发生取代反应和加成反应 |
4.某铝热剂由铁红和铝组成.取a g该铝热剂样品,向其中加入足量的NaOH溶液,测得生成气体的体积为V1 L(标准状况,下同).
另取a g该样品将其引燃,恰好完全反应,待反应产物冷却后,加入足量稀盐酸,测得生成气体的体积为V2 L.若不考虑空气中O2的影响,则V1:V2为( )
另取a g该样品将其引燃,恰好完全反应,待反应产物冷却后,加入足量稀盐酸,测得生成气体的体积为V2 L.若不考虑空气中O2的影响,则V1:V2为( )
| A. | 3:2 | B. | 4:3 | C. | 1:1 | D. | 8:9 |
14.将SO2和18O2充入反应容器,当反应达到平衡时,18O原子将( )
| A. | 存在于氧气和三氧化硫中 | B. | 只存在于三氧化硫中 | ||
| C. | 三种物质中都有 | D. | 无法判断 |
1.某学习小组做了如下实验探究海带中碘元素的存在形式,并测定其中碘元素的含量.
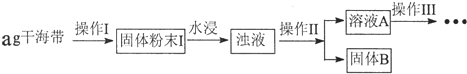
(1)操作Ⅰ为灼烧,则灼烧时应该用坩埚(仪器名称)盛装海带,操作Ⅱ为过滤;
(2)水浸时通常要将悬浊液煮沸2-3min,目的是加快含碘物质在水中的溶解,以使灰烬中的含碘物质尽可能多的进入溶液.
(3)操作Ⅲ,是同学们对溶液A中碘元素的存在形式进行的探究实验.
[推测]:①以IO3-形式存在; ②以I-形式存在
[查阅资料]:IO3-具有较强的氧化性;I2+2S2O32-═2I-+S4O62-将上述溶液稀释配制成200mL溶液,请完成下列实验探究.
限选试剂:3%H2O2溶液、KSCN溶液、FeCl2溶液、稀硫酸
(4)定量检验海带中的碘含量:
①取20mL稀释后溶液A分别于锥形瓶,分别用酸式滴定管滴加0.01mol/LKMnO4溶液至溶液刚显浅红色,将I-氧化为I2并得到溶液B;
②在溶液B加入2滴淀粉溶液,用0.01mol/L Na2S2O3溶液,滴定至终点,终点现象为溶液蓝色刚好褪去,30s内不恢复蓝色,记录数据,重复上测定步骤①、②两次,三次平均消耗Na2S2O3溶液体积为VmL,海带中碘元素的百分含量为$\frac{1.27v}{a}%$.假设操作Ⅰ、Ⅱ中碘不损失,原子量I-127)

(1)操作Ⅰ为灼烧,则灼烧时应该用坩埚(仪器名称)盛装海带,操作Ⅱ为过滤;
(2)水浸时通常要将悬浊液煮沸2-3min,目的是加快含碘物质在水中的溶解,以使灰烬中的含碘物质尽可能多的进入溶液.
(3)操作Ⅲ,是同学们对溶液A中碘元素的存在形式进行的探究实验.
[推测]:①以IO3-形式存在; ②以I-形式存在
[查阅资料]:IO3-具有较强的氧化性;I2+2S2O32-═2I-+S4O62-将上述溶液稀释配制成200mL溶液,请完成下列实验探究.
限选试剂:3%H2O2溶液、KSCN溶液、FeCl2溶液、稀硫酸
| 序号 | 实验操作 | 实验现象 | 结论 |
| ① | 取少量稀释后的溶液A加入淀粉后再用硫酸酸化,分装于试管Ⅰ、Ⅱ | 无现象 | |
| ② | 往试管I中加入FeCl2溶液,后加入2滴KSCN溶液并振荡; | 无现象 | 证明不是以IO3-形式存在 |
| ③ | 往试管II中加入3%H2O2溶液并振荡 | 溶液变蓝 | 证明以I-形式存在 |
①取20mL稀释后溶液A分别于锥形瓶,分别用酸式滴定管滴加0.01mol/LKMnO4溶液至溶液刚显浅红色,将I-氧化为I2并得到溶液B;
②在溶液B加入2滴淀粉溶液,用0.01mol/L Na2S2O3溶液,滴定至终点,终点现象为溶液蓝色刚好褪去,30s内不恢复蓝色,记录数据,重复上测定步骤①、②两次,三次平均消耗Na2S2O3溶液体积为VmL,海带中碘元素的百分含量为$\frac{1.27v}{a}%$.假设操作Ⅰ、Ⅱ中碘不损失,原子量I-127)
18.与主族元素在元素周期表中所处的位置有关的是( )
| A. | 元素的相对原子质量 | B. | 原子的核内中子数 | ||
| C. | 原子的次外层电子数 | D. | 原子的电子层数和最外层电子数 |
19.下列离子方程式书写正确的是( )
| A | 将磁性氧化铁溶于HI溶液:Fe3O4+8H+═Fe2++2Fe3++4H2O |
| B | 明矾[KAl(SO4)2]溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀: 2Ba2++3OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓ |
| C | 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O═2HCO3-+SO32- |
| D | NH4HCO3溶液中滴入过量的NaOH溶液:HCO3-+OH-═CO32-+H2O |
| A. | A | B. | B | C. | C | D. | D |
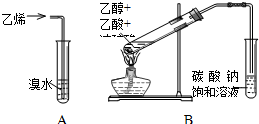 请回答下列问题:
请回答下列问题: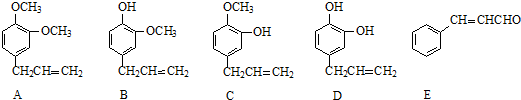
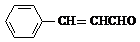 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$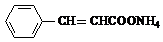 +H2O+2Ag↓+3NH3,Y的结构简式为
+H2O+2Ag↓+3NH3,Y的结构简式为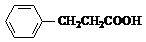 ,反应③属于加成反应.
,反应③属于加成反应.