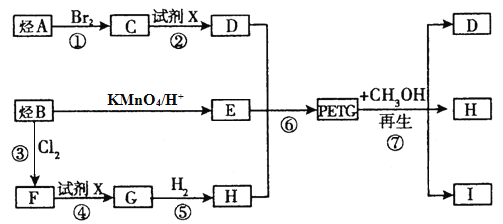
题目内容
【题目】一种直接铁燃料电池(电池反应为3Fe+2O2=Fe3O4)的装置如图所示,下列说法正确的是( )
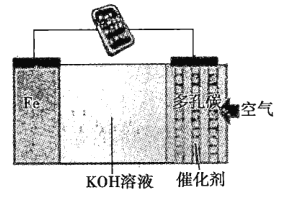
A.Fe极为电池正极
B.KOH溶液为电池的电解质溶液
C.电子由多孔碳极沿导线移向Fe极
D.5.6gFe参与反应,导线中转移1.204×1023个电子
【答案】B
【解析】
A.铁燃料电池中铁失去电子为电池负极,A错误;
B.KOH溶液为电池的电解质溶液,B项正确;
C.电池工作时,电子由负极![]() 沿导线移向正极多孔碳,C错误;
沿导线移向正极多孔碳,C错误;
D.根据电池反应3Fe+2O2=Fe3O4可知,3molFe参与反应时转移8mol电子,5.6gFe的物质的量为0.1mol,当5.6gFe参与反应时,导线中转移电子为0.1![]() mol=1.6051023个,D错误。
mol=1.6051023个,D错误。
答案选B。

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目