题目内容
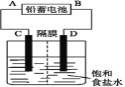
【题目】如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则下列说法正确的是( )
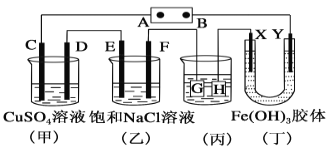
A.电源B极是正极
B.(甲)(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1∶2∶2∶1
C.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
【答案】D
【解析】
将直流电源接通后,F极附近呈红色,说明F极显碱性,是氢离子在该电极放电,所以F即是阴极,B是电源的负极,A是电源的正极,可得出D、F、H、Y均为阴极,C、E、G、X均为阳极。
A.根据上述分析可知B电极是电源的负极,A错误;
B.甲装置中,阳极C电极反应式为:4OH--4e-=O2↑+2H2O,阴极D电极反应式为:Cu2++2e-=Cu;乙装置是阳极E的电极反应为:2Cl--2e-=Cl2↑,阴极F电极的电极反应式为:2H++2e-=H2↑,当各电极转移电子均为1mol时,生成单质的量分别为:0.25mol、0.5mol、0.5mol、0.5mol,所以单质的物质的量之比为1:2:2:2,B错误;
C.电镀装置中,镀层金属必须作阳极,镀件作阴极,所以H应该是镀件,G是镀层金属,电解质溶液必须是含镀层金属离子的盐溶液,用(丙)装置给铜镀银,G应该是Ag,电镀液选用AgNO3溶液,C错误;
D.装置(丁)中Y极附近红褐色变深,证明氢氧化铁胶体微粒移向Y极,依据上述判断,X为阳极,Y为阴极,氢氧化铁胶体向Y电极移动,异性电荷相互吸引,所以氢氧化铁胶体粒子带正电荷,D正确;
故合理选项是D。

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目