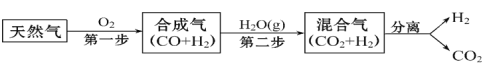
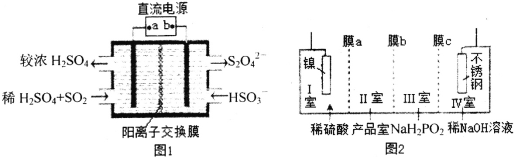
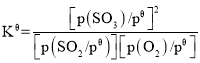题目内容
【题目】下列有机物中,能发生酯化还原、加成、消去四种反应的是( )
A.CH3—CH=CH—CHO
B.HOCH2—CH2—CH=CH—CHO
C.![]()
D.![]()
【答案】B
【解析】
A.有机物中含碳碳双键、—CHO,可发生还原反应、加成反应,不能发生酯化反应、消去反应,故A不选;
B.有机物中含—OH,且与—OH所连碳原子的相邻碳原子上含有H原子,可发生酯化反应、消去反应,有机物中含—CHO、碳碳双键,可发生加成反应、还原反应,故B选;
C.有机物中含—OH,且与—OH所连碳原子的相邻碳原子上含有H原子,可发生酯化反应、消去反应,但不能发生还原反应、加成反应,故C不选;
D.有机物中含—CHO、![]() ,可发生还原反应、加成反应,有机物中含—OH,可发生酯化反应,但与—OH所连碳原子的相邻碳原子上不含H原子,不能发生消去反应,故D不选;
,可发生还原反应、加成反应,有机物中含—OH,可发生酯化反应,但与—OH所连碳原子的相邻碳原子上不含H原子,不能发生消去反应,故D不选;
故答案为B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目