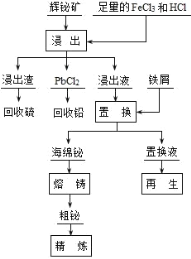
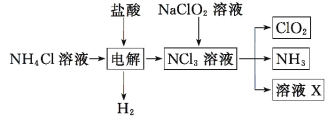
��Ŀ����
����Ŀ�������ڿɳ�����չ����̬������ȫ������������ѡ�IJ�����Ŀ֮һ��
��1����֪��Ӧ 2NO��g��+2CO��g��![]() N2��g��+2CO2��g�� v ��=k ����c2��NO����c2��CO����v ��=k ����c��N2����c2��CO2����k����k��Ϊ���ʳ�����ֻ���¶��йأ���һ�������½��и÷�Ӧ����� CO ��ƽ��ת�������¶ȡ���ʼͶ�ϱ�m=
N2��g��+2CO2��g�� v ��=k ����c2��NO����c2��CO����v ��=k ����c��N2����c2��CO2����k����k��Ϊ���ʳ�����ֻ���¶��йأ���һ�������½��и÷�Ӧ����� CO ��ƽ��ת�������¶ȡ���ʼͶ�ϱ�m=![]() �Ĺ�ϵ��ͼ 1 ��ʾ��
�Ĺ�ϵ��ͼ 1 ��ʾ��

�ٴﵽƽ��������¶ȣ�k������ı���________����>����<������=����k������ı�����
������˵����ȷ����_______��
A Ͷ�ϱȣ�m1<m2<m3
B �����������еĴ�������� NO ��ƽ��ת����
C ��Ͷ�ϱ� m��2 ʱ��NO ת���ʱ� CO ת����С
D ����ϵ�� CO2 �� CO ���ʵ���Ũ��֮�ȱ��ֲ���ʱ����Ӧ�ﵽƽ��״̬
������ 1L ���ܱ������г��� 1 molCO �� 1 mol NO����һ���¶��´ﵽƽ��ʱ��CO ��ת����Ϊ 40%�� �� k ���Uk ��=_______����д�������ɣ����û���
��2���� 2L �ܱ������г��� 2mol CO �� 1mol NO2��������Ӧ 4CO��g��+2NO2��g��![]() N2��g��+4CO2��g�� ��H<0����ͼ 2 Ϊƽ��ʱ CO2 ������������¶ȡ� ѹǿ�Ĺ�ϵ��
N2��g��+4CO2��g�� ��H<0����ͼ 2 Ϊƽ��ʱ CO2 ������������¶ȡ� ѹǿ�Ĺ�ϵ��
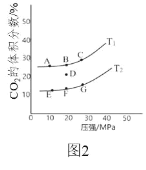
�ٸ÷�Ӧ�ﵽƽ���Ϊ����߷�Ӧ����ͬʱ��� NO ��ת���ʣ��ɲ� ȡ�Ĵ�ʩ��______������ĸ��ţ�
a ���� CO ��Ũ�� b ��С��������� c ���ø�Ч���� d �����¶�
������ D ��Է�Ӧ�������µ�ͬʱ��С�������ϵѹǿ���ﵽ��ƽ��״̬������ͼ�� A G ���е�______�㡣
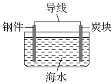
��3��������������ˮ�еĵ���Ⱦ�ѳ�Ϊһ�������ԵĻ������⡣�ڽ���Pt��Cu��ҿ��Ir���Ĵ������£��ܱ������е� H2 �ɸ�Чת��������Һ�е���̬����NO3-�����乤��ԭ������ͼ��ʾ������������ϵ� Pt �������࣬��ɵĺ����______��
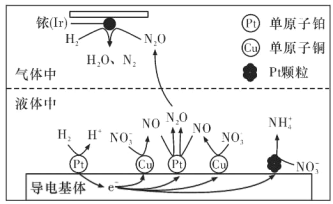
���𰸡�< C D ![]() ab C ��Pt�������࣬NO3-����ת��ΪNH4+������Һ�У������ڽ�����Һ�к�����
ab C ��Pt�������࣬NO3-����ת��ΪNH4+������Һ�У������ڽ�����Һ�к�����
��������
(1)�پ�ͼ1��ʾ������ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ�����k������ı�����k������ı�����
��A. ��ͼ���֪���¶�һ��ʱ������NOŨ�ȣ�COת����������ʼͶ�ϱ�mԽ��ʱ��COת����Խ������Ͷ�ϱȣ�m1��m2��m3����A����
B. ����ֻ�ı䷴Ӧ���ʣ����ı�ƽ��ת���ʣ���B����
C. �ɷ�Ӧ������ϵ��֪����Ӧ��NO��CO�ı仯����ͬ��ƽ��ת������=![]() ��100%������ƽ��ת��������ʼ���ɷ��ȣ���Ͷ�ϱ�m=2ʱCOת������NOת���ʵ�2������C��ȷ��
��100%������ƽ��ת��������ʼ���ɷ��ȣ���Ͷ�ϱ�m=2ʱCOת������NOת���ʵ�2������C��ȷ��
D. ��Ӧ�����ƶ�ʱCO2Ũ������COŨ�ȼ�С����ƽ���ƶ������ж���Ũ�ȱ�ֵ�ᷢ���仯�����Ե����߱�ֵ����ʱ˵����Ӧ�ﵽƽ�⣬��D��ȷ��
�ʴ�Ϊ��CD��
������ 1L ���ܱ������г��� 1 mol CO �� 1 mol NO����һ���¶��´ﵽƽ��ʱ��CO ��ת����Ϊ 40%��������ʽ�У�
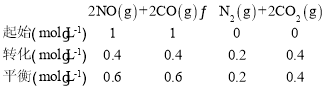
�ﵽƽ��״̬ʱ���淴Ӧ������ȣ���k ��c2(NO)c2(CO)=k ��c(N2)c2(CO2)��
��![]() ��
��
(2)��a. ����CO��Ũ��ƽ�������ƶ���NOת������ߣ���a��ȷ��
b. ��С����������൱������ѹǿƽ�������ƶ���NOת������ߣ���b��ȷ��
c. ���ø�Ч������ֻ�ı仯ѧ��Ӧ���ʲ�Ӱ��ƽ���ƶ�������NOת���ʲ��䣬��c����
d. �÷�Ӧ�ʱ�С���㣬����ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���NOת���ʽ��ͣ���d����
��ѡab��
����ͬѹǿ�½����¶�ƽ�������ƶ���CO2�����������ͬһ�¶�������ѹǿƽ�������ƶ�CO2��������������Է���������ΪC��
(3)��ԭ����ʾ��ͼ��֪������������ϵ�Pt�������࣬��NO3-������ת����笠��������ڽ�����Һ�еĺ�������

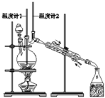
����Ŀ����֪��CH3CH2CH2CH2OH![]() CH3CH2CH2CHO��������ͼװ�����������ϳ�����ȩ������������
CH3CH2CH2CHO��������ͼװ�����������ϳ�����ȩ������������
���� | �е�/�� | �ܶ� / gcm-3 | ˮ���ܽ��� |
|
������ | 117.2 | 0.8109 | �� | |
����ȩ | 75.7 | 0.8017 | �� |
����˵���У�����ȷ����
A.Ϊ��ֹ�����һ��������Ӧ���ữ��Na2Cr2O7��Һ��μ�����������
B.���¶ȼ�1ʾ��Ϊ90~95�����¶ȼ�2ʾ����76������ʱ���ռ�����
C.��Ӧ������������ﵹ���Һ©���У���ȥˮ�㣬������ȩ�ӷ�Һ©���Ͽڵ���
D.���õĴ�����ȩ�м������������ƣ����������Ƿ���������