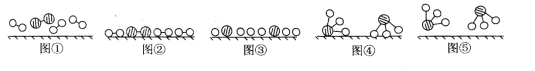
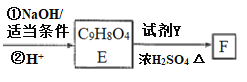
题目内容
【题目】已知NaClO2在水溶液中能发生水解。常温时,有1 mol/L的HClO2溶液和1mol/L的HBF4(氟硼酸)溶液起始时的体积均为V0,分别向两溶液中加水,稀释后溶液的体积为V,所得曲线如图所示。下列说法错误的是
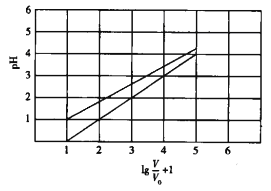
A. HClO2为弱酸,HBF4为强酸
B. 常温下HClO2的电高平衡常数的数量级为10—4
C. 在0≤pH≤5时,HBF4溶液满足pH=lg(V/V0)
D. 25℃时1L pH=2的HBF4溶液与100℃时1L pH=2的HBF4溶液消耗的NaOH相同
【答案】B
【解析】
A.lg![]() +1=1时pH=0,则V=V0,即1mol/L HBF4溶液pH=0,说明HBF4是强酸;而NaClO2在水溶液中能发生水解,说明HClO2是弱酸,故A正确;B.对于HClO2溶液,当lg
+1=1时pH=0,则V=V0,即1mol/L HBF4溶液pH=0,说明HBF4是强酸;而NaClO2在水溶液中能发生水解,说明HClO2是弱酸,故A正确;B.对于HClO2溶液,当lg![]() +1=1时pH=1,则V=V0,即1mol/L HClO2溶液中c(H+)=0.1mol,常温下HClO2的电离平衡常数Ka=
+1=1时pH=1,则V=V0,即1mol/L HClO2溶液中c(H+)=0.1mol,常温下HClO2的电离平衡常数Ka= 1×10-2,即HClO2的电高平衡常数的数量级为10—2,故B错误;C.lg
1×10-2,即HClO2的电高平衡常数的数量级为10—2,故B错误;C.lg![]() +1=1时pH=0,则V=V0,即1mol/L HBF4溶液pH=0,说明HBF4是强酸,pH=-lgc(H+),溶液稀释多少倍,溶液中c(H+)为原来的多少分之一,所以在0≤pH≤5时,HMnO4溶液满足:pH=lg
+1=1时pH=0,则V=V0,即1mol/L HBF4溶液pH=0,说明HBF4是强酸,pH=-lgc(H+),溶液稀释多少倍,溶液中c(H+)为原来的多少分之一,所以在0≤pH≤5时,HMnO4溶液满足:pH=lg![]() ,故C正确;D.25℃时pH=2的HBF4溶液与100℃时pH=2的HBF4溶液中c(H+)均为0.01mol/L,则体积均为1L的两溶液完全中和消耗的NaOH相同,故D正确;故答案为B。
,故C正确;D.25℃时pH=2的HBF4溶液与100℃时pH=2的HBF4溶液中c(H+)均为0.01mol/L,则体积均为1L的两溶液完全中和消耗的NaOH相同,故D正确;故答案为B。

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目