题目内容
6.28g铜金合金与足量的某浓度HNO3反应,将产生的气体和2.24L(标准状况)O2混合,通入水中,气体恰好被完全吸收,则合金中铜的质量为( )| A. | 9.6g | B. | 6.4g | C. | 12.8g | D. | 8g |
分析 铜金合金中Cu与硝酸反应生成硝酸铜与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属Cu提供的电子等于氧气获得的电子,根据电子转移守恒计算Cu的物质的量,再根据m=nM计算Cu的质量.
解答 解:铜金合金中Cu与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属Cu提供的电子等于氧气获得的电子,n(O2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,根据电子转移守恒,Cu的物质的量为$\frac{0.1mol×4}{2}$=0.2mol,则合金中Cu的质量为0.2mol×64g/mol=12.8g,
故选:C.
点评 本题考查混合物计算的有关计算,难度中等,根据反应过程判断金属提供的电子等于氧气获得的电子是关键,注意氧化还原反应中守恒思想的运用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.下列说法正确的是( )
| A. | 已知30℃时Kw=3.80×10-14,则30℃时c(H+)=1.00×10-7mol/L的溶液是酸性的 | |
| B. | 正常成人胃液的pH=1.4,婴儿(体温与成人相同)胃液的pH=5.0,鉴于人的正常体温不是25℃,故两种胃液的c(OH-)不可能相差103.6倍 | |
| C. | 新制氯水中加入少量的NaHSO3晶体不会使c(HClO)增大 | |
| D. | 在熔融状态下,1molKHSO4完全电离出的阳离子数目为2NA |
17.关于实验室制乙炔的说法不正确的是( )
| A. | 因反应太剧烈,可用分液漏斗控制滴水速度来控制反应速度 | |
| B. | 为了得到比较平缓的乙炔气流,可用饱和食盐水代替水 | |
| C. | 乙炔气体中混有PH3和H2S等杂质,可用硫酸铜溶液将其除去 | |
| D. | 为控制反应的速率,可用碳化钙粉末和饱和食盐水反应 |
1.下列物质的变化中,有共价键明显被破坏的是( )
| A. | I2升华 | B. | NaCl颗粒被粉碎 | ||
| C. | 溴蒸汽被木炭吸附 | D. | 从NH4HCO3中闻到了刺激性气味 |
 ;若取一定量的B完全燃烧后,生成3mol CO2和1.5mol H2O,则有39g烃B参加了反应,燃烧时消耗氧气3.75mol.
;若取一定量的B完全燃烧后,生成3mol CO2和1.5mol H2O,则有39g烃B参加了反应,燃烧时消耗氧气3.75mol. +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O,取代反应.
+3H2O,取代反应. ,加聚反应(或聚合反应).
,加聚反应(或聚合反应).
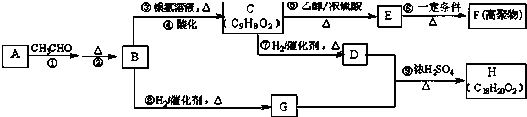
 .
. +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$ +H2O
+H2O
 +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$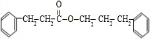 +H2O.
+H2O. .
.