题目内容
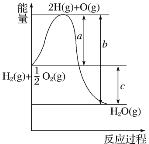
【题目】已知H2(g)+![]() O2(g)=H2O(g),如图是1molH2燃烧的反应过程中能量变化示意图。
O2(g)=H2O(g),如图是1molH2燃烧的反应过程中能量变化示意图。
请回答下列问题:
(1)该反应是__(填“吸热”或“放热”)反应。
(2)氢气在氧气中燃烧,破坏1molH—H键吸收Q1kJ的能量,破坏1molO=O键吸收Q2kJ的能量,形成1molH—O键释放Q3kJ的能量,则下列关系式正确的是___。
A.2Q1+Q2>4Q3 B.2Q1+Q2<4Q3
C.Q1+Q2<Q3 D.2Q1+Q2=4Q3
(3)已知1gH2(g)完全燃烧生成水蒸气时放出热量121kJ,且O2(g)中1molO=O键完全断裂时吸收热量496kJ,H2O(g)中1molH—O键形成时放出热量463kJ,则H2(g)中1molH—H键断裂时吸收热量为__kJ。
【答案】放热 B 436
【解析】
(1)反应物中的能量大于生成物中的能量,因此是放热反应;
(2)因为这是一个放热反应,所以断裂旧键所消耗的能量,小于生成新键所释放的能量;
(3)形成新键所释放的能量,减去断裂旧键时消耗的能量,就是反应一共放出的能量,据此来计算即可。
(1)反应物中的能量大于生成物中的能量,因此这是一个放热反应;
(2)氢气在氧气中燃烧的反应为2H2(g)+O2(g)=2H2O(g),反应释放能量。在该反应中破坏2molH—H键、1molO=O键,形成4molH—O键,所以2Q1+Q2<4Q3;
(3)因为1gH2(g)完全燃烧生成H2O(g)时放出热量121kJ,所以1molH2(g)与![]() molO2(g)完全燃烧生成1molH2O(g)时放出热量242kJ。反应过程中断裂1molH—H键和
molO2(g)完全燃烧生成1molH2O(g)时放出热量242kJ。反应过程中断裂1molH—H键和![]() molO=O键需要吸收的能量为
molO=O键需要吸收的能量为![]() ×496kJ+EH—H,形成2molO—H键释放的能量为2×463kJ=926kJ,所以926kJ-(
×496kJ+EH—H,形成2molO—H键释放的能量为2×463kJ=926kJ,所以926kJ-(![]() ×496kJ+EH—H)=242kJ,解得EH—H=436kJ。
×496kJ+EH—H)=242kJ,解得EH—H=436kJ。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分Co2O3),含少量Fe2O3、MnO2、Al2O3、CaO、MgO、碳及有机物等)制取草酸钴(CoC2O3)的工艺流程如下:
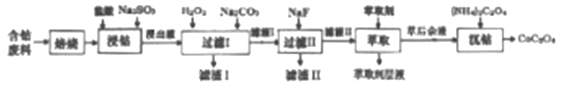
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等。
②部分阳离子一氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀时的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③Kap(MgF2)=7.35×10-11,Kap(CaF2)=1.05×10-10
回答下列问题:
(1)焙烧的目的是_________;浸钴过程中Co3+转化为Co2+,反应的离子方程式为_____________。
(2)加入H2O2的目的是__________,加入Na2CO3溶液,调pH至5.2,滤渣Ⅰ主要成分为__________。
(3)加入过量NaF溶液,可将Ca2+、Mg2+除去,若所得滤液中c(Ca2+)=1.0×10-5mol·L-1,则滤液中c(Mg2+)为_______________。
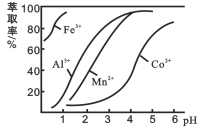
(4)萃取剂对金属离子的萃取率与pH的关系如下图所示。滤液Ⅱ中加入萃取剂的作用是_________;萃取时,溶液的pH需要控制在一定范围内才比较适宜,其pH范围约为__________。
(5)已知含钴废料中含Co2O3质量分数为a%,若取mg该含钴废料按照上述流程,理论上最多能制得CoC2O4的质量为__________g(列出计算式即可)。