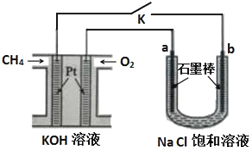
题目内容
【题目】Ba(NO3)2常用于军事上生产绿色信号弹、曳光弹等。某生产BaCO3的化工厂生产排出大量的钡泥(主要含有BaCO3、BaSO3、Ba(FeO2)2等,该厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),部分工艺流程如下:
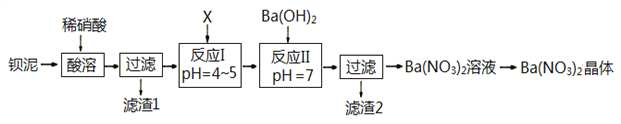
已知:pH=3.2时,可使Fe3+沉淀完全;
请回答下列问题:
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌、过滤、洗涤。试用离子方程式说明提纯原理:______________________________。
(2)酸溶时,Ba(FeO2)2与HNO3反应的化学方程式为_______________________________。
(3)该厂结合本厂实际,化合物X最好选用_________
A.BaCl2 B.Ba(OH)2 C.Ba(NO3)2 D.BaCO3
(4)滤渣1和滤渣2洗涤产生的废液不能直接排入环境,原因是_______________________。
(5)①反应I需调节溶液pH值范围在4~5,目的是________________________________。
②验证该步骤中沉淀已完全的实验操作是_____________________________________。
(6)测定所得Ba(NO3)2晶体的纯度:准确称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m克,则该晶体的纯度为_____________。(提示:M(Ba(NO3)2)= 261 g/mol,M(BaSO4)= 233 g/mol)
【答案】 BaSO4(s)+ CO32-(aq)![]() BaCO3(s)+ SO42- (aq) Ba(FeO2)2 + 8HNO3=Ba(NO3)2+2Fe(NO3)3+4H2O D 废液中含有的重金属离子Ba2+会污染环境 中和溶液中过量的H+,促进溶液中Fe3+水解而形成Fe(OH)3沉淀 取上层清液于试管中,往其中滴入几滴KSCN溶液,若不变血红色,则证明沉淀已完全
BaCO3(s)+ SO42- (aq) Ba(FeO2)2 + 8HNO3=Ba(NO3)2+2Fe(NO3)3+4H2O D 废液中含有的重金属离子Ba2+会污染环境 中和溶液中过量的H+,促进溶液中Fe3+水解而形成Fe(OH)3沉淀 取上层清液于试管中,往其中滴入几滴KSCN溶液,若不变血红色,则证明沉淀已完全 ![]()
【解析】钡泥主要含BaCO3、BaSO3、Ba(FeO2)2等,加入硝酸,在容器中充分溶解,可生成硫酸钡,过滤后滤液中含有铁离子、钡离子等,且溶液呈酸性,可加入碳酸钡,调节溶液pH=4~5,使铁离子水解生成Fe(OH)3沉淀,过滤后废渣为Fe(OH)3,滤液中含有硝酸、硝酸钡等,加入氢氧化钡中和得到硝酸钡溶液,经蒸发、浓缩、过滤可得到硝酸钡晶体。
(1)溶液存在BaSO4(aq)+CO32-(aq)BaCO3(aq)+SO42-(aq),当c(CO32-)×c(Ba2+)>Ksp(BaCO3)时,可实现沉淀的转化,故答案为:BaSO4(aq)+CO32-(aq)BaCO3(aq)+SO42-(aq);
(2)Ba(FeO2)2与中钡元素为+2价,铁元素为+3价,所以反应产物为Ba(NO3)2和Fe(NO3)3,所以其反应方程式为:Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O,故答案为:Ba(FeO2)2+8HNO3 =Ba(NO3)2+2Fe(NO3)3+4H2O;
(3)加入X调节溶液的pH=4~5,则X应能消耗H+,结合工厂主要生产BaCl2、BaCO3、BaSO4的实际情况,可选用BaCO3,故答案为:D;
(4)滤渣1和滤渣2洗涤产生的废液中含有的重金属离子Ba2+会污染环境,不能直接排入环境,故答案为:废液中含有的重金属离子Ba2+会污染环境;
(5)①反应I需调节溶液pH值范围在4~5,中和溶液中过量的H+,促进溶液中Fe3+水解而形成Fe(OH)3沉淀,②验证该步骤中沉淀已完全,只需要检验溶液中是否存在铁离子,实验操作和现象为取上层清液于试管中,往其中滴入几滴KSCN溶液,若不变血红色,则证明沉淀已完全,故答案为:中和溶液中过量的H+,促进溶液中Fe3+水解而形成Fe(OH)3沉淀;取上层清液于试管中,往其中滴入几滴KSCN溶液,若不变血红色,则证明沉淀已完全;
(6)称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m克,其发生的反应为:Ba(NO3)2+H2SO4=BaSO4+2HNO3,设参加反应的Ba(NO3)2为xg,
Ba(NO3)2+H2SO4=BaSO4+2HNO3
261 233
x mg
则解得x=![]() g,所以该Ba(NO3)2的纯度为
g,所以该Ba(NO3)2的纯度为![]() ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%。
×100%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】纳米碳酸钙是一种广泛应用于塑料、食品、医药、饲料等行业的重要无机填料。以磷石膏钙渣为原料制取高品质纳米碳酸钙的工艺流程如下:

已知某磷石膏钙渣的主要成分及其含量如下表所示。
CaO | P2O5 | SO3 | Fe2O3 | Al2O3 | SiO2 | 烧失量 |
47.70% | 1.60% | 1.77% | 0.041% | 0.0027% | 9.85% | 37.69% |
请回答下列问题:
(1)对磷石膏钙渣进行酸溶的目的是获得机制CaCl2溶液,为了提高溶出率,可以采取的措施有______。(回答两条即可)
(2)为了探究酸溶的工艺条件,称取6 份各50g磷石膏钙渣,分别用不同浓度盐酸进行溶解,反应时间为30 min,测得滤液中钙溶出率的结果如图所示,最适宜的盐酸浓度为_______。

(3)精制是向粗制CaCl2溶液中通入氨气,控制溶液的pH,主要除去________ (填金属阳离子)。
(4)碳化时,先将精制CaCl2溶液稀释至一定体积,控制反应温度以及NH3和CO2 的通入量,此过程中,通入气体有先后顺序,应先通入气体的化学式_______(填化学式);碳化时发生反应的化学方程式为______。
(5)把CaCO3浊液滴入1.0molL-1 的Na2SO3溶液中,能否产生CaSO3沉淀?_______。若不能,说明原因;若能,请从定量的角度简述判断依据:_______。[已知:Ksp(CaSO3)=1.4×10-7,Ksp(CaCO3)=2.8×10-9]
(6)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级:__________。