题目内容
【题目】高岭土主要由高岭石![]() 长期风化而成,其中还含有一定量的白云石
长期风化而成,其中还含有一定量的白云石![]() ,高岭土是制作陶瓷的原料。完成下列填空:
,高岭土是制作陶瓷的原料。完成下列填空:
(1)矿石中除![]() 外的三种非金属元素的原子半径从小到大的顺序是______。硅原子的核外电子排布式是___,镁原子核外有_________种能量不同的电子。
外的三种非金属元素的原子半径从小到大的顺序是______。硅原子的核外电子排布式是___,镁原子核外有_________种能量不同的电子。
(2)判断![]() 的金属性强于
的金属性强于![]() 的事实是____________。
的事实是____________。
a. ![]() 的碱性强于
的碱性强于![]()
b. ![]() 微溶于水,
微溶于水,![]() 难溶于水
难溶于水
c. 与热水反应,钙比镁剧烈
d. 单质钙保存在煤油里,单质镁不需要
(3)![]() 和
和![]() 同是ⅣA族元素的氧化物,
同是ⅣA族元素的氧化物,![]() 的熔点明显比
的熔点明显比![]() 高的原因是________。
高的原因是________。
(4)氮化硅(![]() )是一种新型陶瓷材料,制备反应如下:
)是一种新型陶瓷材料,制备反应如下:![]() ,该反应的平衡常数表达式___________;反应达到平衡后,若增大
,该反应的平衡常数表达式___________;反应达到平衡后,若增大![]() 浓度,则
浓度,则![]() 值____________(填“增大”“减小”或“不变”)。
值____________(填“增大”“减小”或“不变”)。
【答案】![]()
![]()
![]()
![]() 4 ac
4 ac ![]() 属于分子晶体,熔沸点由范德华力决定,
属于分子晶体,熔沸点由范德华力决定,![]() 是原子晶体,熔沸点由共价键决定,因为共价键大于范德华力,故
是原子晶体,熔沸点由共价键决定,因为共价键大于范德华力,故![]() 熔沸点高。
熔沸点高。 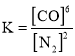 不变
不变
【解析】
(1)矿石中除![]() 外的三种非金属元素是Si、O、C,三者的原子半径O<C<Si。硅原子的核外电子排布式是
外的三种非金属元素是Si、O、C,三者的原子半径O<C<Si。硅原子的核外电子排布式是![]() ;镁原子核外电子排布式为1s22s22p63s2,有4种不同的轨道,所以有4种能量不同的电子。
;镁原子核外电子排布式为1s22s22p63s2,有4种不同的轨道,所以有4种能量不同的电子。
(2)a. 碱性越强,金属性越强,![]() 的碱性强于
的碱性强于![]() ,所以钙的金属性强于镁,正确;
,所以钙的金属性强于镁,正确;
b. 虽然![]() 微溶于水,
微溶于水,![]() 难溶于水,但溶解性与碱性强弱无关,错误;
难溶于水,但溶解性与碱性强弱无关,错误;
c. 与热水反应,金属性越强,与热水反应越剧烈,钙比镁剧烈,所以金属性钙比镁强,正确;
d. 单质钙保存在煤油里,隔绝空气,防止被氧化;单质镁不需要,不是因为不活泼,而是因为生成的MgO致密,阻止内部金属的进一步反应,所以不能由存放方式判断金属的活动性强弱,错误。
故选ac。
(3)![]() 和
和![]() 同是ⅣA族元素的氧化物,
同是ⅣA族元素的氧化物,![]() 的熔点明显比
的熔点明显比![]() 高的原因是
高的原因是![]() 属于分子晶体,熔沸点由范德华力决定,
属于分子晶体,熔沸点由范德华力决定,![]() 是原子晶体,熔沸点由共价键决定,因为共价键大于范德华力,故
是原子晶体,熔沸点由共价键决定,因为共价键大于范德华力,故![]() 熔沸点高。
熔沸点高。
(4)反应![]() 中,SiO2、C、Si3N4为固体,不能出现在平衡常数表达式中,该反应的平衡常数表达式
中,SiO2、C、Si3N4为固体,不能出现在平衡常数表达式中,该反应的平衡常数表达式 。反应达到平衡后,若增大
。反应达到平衡后,若增大![]() 浓度,虽然平衡右移,但由于温度不变,所以
浓度,虽然平衡右移,但由于温度不变,所以![]() 值不变。
值不变。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】某研究小组探究氨基甲酸铵(NH2COONH4)分解的化学平衡和水解反应速率。
(1)将一定量纯净的氨基甲酸铵置于固定容积为 100mL 的密闭真空溶液 A 中,在恒定温度下使其达到分解 平衡。实验测得不同温度下的平衡数据列于下表:
温度(℃) | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总物质的量(mol) | 0.34 | 0.48 | 0.68 | 0.94 |
①氨基甲酸铵分解的化学方程式为 NH2COONH4(s) 2NH3(g)+CO2(g),若 25.0℃时达到平衡所用时间为8min,根据数据计算 NH3 的平均生成速率为__________。
②可以判断该分解反应已经达到化学平衡的是_____。
A. 2v(NH3)正=v(CO2)逆
B.密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变
D. 密闭容器中氨气的体积分数不变
(2)已知:NH2COONH4+2H2O NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵 溶液测定水解反应速率,得到 c(NH2COO-)随时间变化趋势如图所示。根据图中信息,如何说明水解反应速率随温度升高而增大:_____。

(3)合成氨工业对国民经济和社会发展具有重要意义。工业合成氨常用的催化剂是_____,氨分子的电子式是_____。
(4)如图是一定的温度和压强下时 N2 和 H2 反应生成 1molNH3 过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:__________________________。(热量 Q 的数值使用含字母 a、b 的代数式表示)

(5)在催化剂存在下,NH3 可用来消除 NO 的污染,生成两种对环境无害的物质。写出反应的化学方程式:_____________________;该反应中氧化产物与还原产物的物质的量之比是_______________。