题目内容
中学常见反应的化学方程式有A+B→X+Y+H2O或H2O+A+B→X+Y(未配平,反应条件略去),下列问题所涉及反应式中的H2O已经略去.请回答:
(1)常温下,若A为黄绿色气体,B为非金属氧化物,A、B均能使品红溶液褪色,A+B→X+Y,且相对分子质量X>Y,则该反应的化学方程式为 ,检验Y中阴离子的试剂是 .
(2)若Y是黄绿色气体,且A、B的物质的量之比为1:4,该反应的化学方程式是 .
(3)若A为常见的金属单质,Y为气态单质,B溶液呈强酸性或强碱性时,A和B反应都能进行.写出A与B反应的离子方程式: ; .
(4)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,其中A、B的物质的量之比为1:4,则反应中氧化剂与还原剂的物质的量之比是 .
(5)若A、B均为化合物,Y为白色沉淀(不含金属元素),B为引起温室效应的主要气体,将B通入某溶液后可生成Y,写出Y可能的化学式 .写出生成Y的一个离子方程式 .
(1)常温下,若A为黄绿色气体,B为非金属氧化物,A、B均能使品红溶液褪色,A+B→X+Y,且相对分子质量X>Y,则该反应的化学方程式为
(2)若Y是黄绿色气体,且A、B的物质的量之比为1:4,该反应的化学方程式是
(3)若A为常见的金属单质,Y为气态单质,B溶液呈强酸性或强碱性时,A和B反应都能进行.写出A与B反应的离子方程式:
(4)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,其中A、B的物质的量之比为1:4,则反应中氧化剂与还原剂的物质的量之比是
(5)若A、B均为化合物,Y为白色沉淀(不含金属元素),B为引起温室效应的主要气体,将B通入某溶液后可生成Y,写出Y可能的化学式
考点:无机物的推断
专题:推断题
分析:(1)A为黄绿色气体,应为Cl2,B为非金属氧化物,A、B均能使品红溶液褪色,则B为SO2,二者反应生成盐酸和硫酸,A+B→X+Y,且相对分子质量X>Y,则X为H2SO4,Y为HCl;
(2)Y是黄绿色气体,应为Cl2,且A、B的物质的量之比为1:4,则A、B的反应应为浓盐酸和二氧化锰的反应,用于实验室制备氯气;
(3)若A为常见的金属单质,Y为气态单质,B溶液呈强酸性或强碱性时,A和B反应都能进行,则A为Al,B为强碱或非氧化性酸溶液,Y为H2;
(4)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,应为C元素,B的溶液为某浓酸,其中A、B的物质的量之比为1:4,应为C和浓硝酸的反应;
(5)Y为白色沉淀(不含金属元素),应为H2SiO3,B为引起温室效应的主要气体,应为CO2,A、B的反应应为可溶性硅酸盐和二氧化碳的反应.
(2)Y是黄绿色气体,应为Cl2,且A、B的物质的量之比为1:4,则A、B的反应应为浓盐酸和二氧化锰的反应,用于实验室制备氯气;
(3)若A为常见的金属单质,Y为气态单质,B溶液呈强酸性或强碱性时,A和B反应都能进行,则A为Al,B为强碱或非氧化性酸溶液,Y为H2;
(4)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,应为C元素,B的溶液为某浓酸,其中A、B的物质的量之比为1:4,应为C和浓硝酸的反应;
(5)Y为白色沉淀(不含金属元素),应为H2SiO3,B为引起温室效应的主要气体,应为CO2,A、B的反应应为可溶性硅酸盐和二氧化碳的反应.
解答:
解:(1)A为黄绿色气体,应为Cl2,B为非金属氧化物,A、B均能使品红溶液褪色,则B为SO2,二者反应生成盐酸和硫酸,A+B→X+Y,且相对分子质量X>Y,则X为H2SO4,Y为HCl,反应的化学方程式为Cl2+SO2+2H2O=2HCl+H2SO4,检验氯离子,可加入硝酸酸化的硝酸银,生成的氯化银不溶于硝酸,
故答案为:Cl2+SO2+2H2O=2HCl+H2SO4;AgNO3和稀硝酸;
(2)Y是黄绿色气体,应为Cl2,且A、B的物质的量之比为1:4,则A、B的反应应为浓盐酸和二氧化锰的反应,用于实验室制备氯气,反应的化学方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(3)若A为常见的金属单质,Y为气态单质,B溶液呈强酸性或强碱性时,A和B反应都能进行,则A为Al,B为强碱或非氧化性酸溶液,Y为H2,A与B反应的离子方程式为2Al+6H+═2Al3++3H2↑或2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2Al+6H+═2Al3++3H2↑;2Al+2OH-+2H2O═2AlO2-+3H2↑;
(4)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,应为C元素,B的溶液为某浓酸,其中A、B的物质的量之比为1:4,应为C和浓硝酸的反应,反应的方程式为C+4HNO3=CO2↑+4NO2↑+2H2O,反应中氧化剂与还原剂的物质的量之比是4:1,故答案为:4:1;
(5)Y为白色沉淀(不含金属元素),应为H2SiO3,B为引起温室效应的主要气体,应为CO2,A、B的反应应为可溶性硅酸盐和二氧化碳的反应,反应的离子方程式为H2O+CO2+SiO32-=H2SiO3↓+CO32-或H2O+2CO2+SiO32-=H2SiO3↓+2HCO3-,
故答案为:H2SiO3;H2O+CO2+SiO32-=H2SiO3↓+CO32-或H2O+2CO2+SiO32-=H2SiO3↓+2HCO3-.
故答案为:Cl2+SO2+2H2O=2HCl+H2SO4;AgNO3和稀硝酸;
(2)Y是黄绿色气体,应为Cl2,且A、B的物质的量之比为1:4,则A、B的反应应为浓盐酸和二氧化锰的反应,用于实验室制备氯气,反应的化学方程式为MnO2+4HCl(浓)
| ||
故答案为:MnO2+4HCl(浓)
| ||
(3)若A为常见的金属单质,Y为气态单质,B溶液呈强酸性或强碱性时,A和B反应都能进行,则A为Al,B为强碱或非氧化性酸溶液,Y为H2,A与B反应的离子方程式为2Al+6H+═2Al3++3H2↑或2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2Al+6H+═2Al3++3H2↑;2Al+2OH-+2H2O═2AlO2-+3H2↑;
(4)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,应为C元素,B的溶液为某浓酸,其中A、B的物质的量之比为1:4,应为C和浓硝酸的反应,反应的方程式为C+4HNO3=CO2↑+4NO2↑+2H2O,反应中氧化剂与还原剂的物质的量之比是4:1,故答案为:4:1;
(5)Y为白色沉淀(不含金属元素),应为H2SiO3,B为引起温室效应的主要气体,应为CO2,A、B的反应应为可溶性硅酸盐和二氧化碳的反应,反应的离子方程式为H2O+CO2+SiO32-=H2SiO3↓+CO32-或H2O+2CO2+SiO32-=H2SiO3↓+2HCO3-,
故答案为:H2SiO3;H2O+CO2+SiO32-=H2SiO3↓+CO32-或H2O+2CO2+SiO32-=H2SiO3↓+2HCO3-.
点评:本题考查无机物的推断,为高频考点,侧重于学生的分析能力的考查,注意把握相关无机物的性质以及反应的特征,难度不大.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
实验室制取少量干燥的氨气涉及下列装置,其中正确的是( )
A、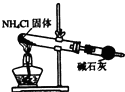 氨气发生装置 |
B、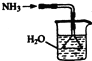 氨气吸收装置 |
C、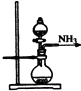 氨气发生装置 |
D、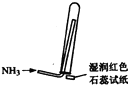 氨气收集、检验装置 |
用下列实验装置进行相应实验,能达到实验目的是( )
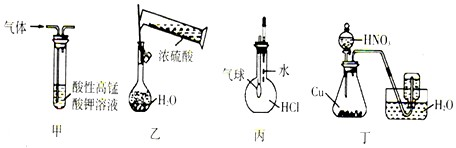

| A、装置甲:除去乙烯中混有的少量SO2 |
| B、装置乙:用浓硫酸配制1mol/L的硫酸 |
| C、装置丙:检验HCl气体在水中的溶解性 |
| D、装置丁:用铜和浓硝酸反应制取NO2 |
下列装置或操作能达到实验目的是( )
A、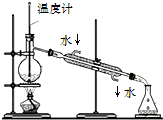 蒸馏石油 |
B、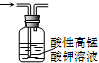 除去甲烷中少量乙烯 |
C、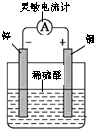 验证化学能转变电能 |
D、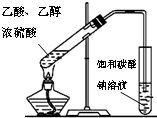 制取乙酸乙酯 |
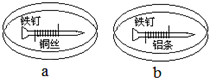 如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( )
如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( )| A、a中铁钉附近呈现红色 |
| B、b中铝条附近有气泡产生 |
| C、a中铜丝上发生氧化反应 |
| D、b中铁钉上发生还原反应 |
生活中常用到一些化学知识,下列说法中不正确的是( )
| A、医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡不溶于水 |
| B、未成熟的苹果肉遇碘酒变蓝色,成熟苹果的汁液能与银氨溶液发生反应 |
| C、某雨水样品放置一段时间后pH由4.68变为4.28,是因为水中的亚硫酸逐渐被空气中氧气氧化成硫酸 |
| D、棉花和木材的主要成分都是纤维素,蚕丝和蜘蛛丝的主要成分都是蛋白质 |
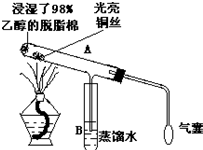 有关催化剂的催化机理等问题可从“乙醇催化氧化”实验得到一些认识,其实验装置如图:
有关催化剂的催化机理等问题可从“乙醇催化氧化”实验得到一些认识,其实验装置如图: (1)在蔗糖中加入浓H2SO4,反应的化学方程式为
(1)在蔗糖中加入浓H2SO4,反应的化学方程式为