题目内容
(8分)将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:
3A(g)+B(g) xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
(1)此时A的浓度c(A)=________mol/L,反应开始前容器中的A、B的物质的量:
n(A)=n(B)=________mol;
(2)B的平均反应速率v(B)=________mol/(L·min);
(3)x的值为________。
(8分,每空2分)(1)0.75 3 (2)0.05 (3)2
解析试题分析:(1)5min后D的浓度为0.5 mol/L,所以D的物质的量是1mol,说明消耗B的物质的量是0.5mol,消耗A是1.5mol,设A、B的起始物质的量均是xmol,则此时A的物质的量x-1.5mol,B的物质的量是x-0.5mol,所以(x-1.5)/( x-0.5)=3:5,解得x=3,所以此时A的浓度c(A)=(3-1.5)mol/2L=0.75mol/L,n(A)=n(B)=3mol;
(2)B的浓度减少0.5mol/2L=0.25mol/L,所以B的平均反应速率v(B)=0.25mol/L/5min=0.05 mol/(L·min);
(3) C的平均反应速率为0.1 mol/(L·min),则C的浓度为0.1 mol/(L·min) ×5min=0.5mol/L,根据物质的浓度的改变量之比等于系数之比得x:2=0.5mol/L: 0.5 mol/L,所以x=2.
考点:考查化学反应速率、化学计量数的计算

硫酸是一种重要的化工产品,硫酸的消耗量常被视为一个国家工业发达水平的一种标志。目前主要生产方法是“接触法”,有关2SO2+O2 2SO3的说法中,不正确的是
2SO3的说法中,不正确的是
| A.该反应为可逆反应,故在一定条件下SO2和O2不可能全部转化为SO3 |
| B.达到平衡后,反应就停止了,故正、逆反应速率相等且均为零 |
| C.一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻之后,正、逆反应速率相等 |
| D.平衡时SO2、O2、SO3的分子数之比不再改变 |
在一定温度下,将两种气体M和N通入容积为V L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法不正确的是 ( )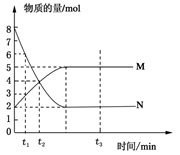
| A.t2时M与N的物质的量浓度之比为1:1 |
| B.t2与t3时刻的混合气体的平均相对分子质量相等 |
| C.反应物与生成物平衡时的物质的量浓度之比是2:5 |
D.0~t2内用M表示的平均反应速率是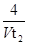 mol/(L?min) mol/(L?min) |
实验室用铜与稀硝酸制取NO时,为加快反应速率可采取的措施是
| A.增加铜的用量 | B.增大压强 |
| C.隔绝空气加热 | D.增大硝酸的浓度 |
(7分)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),达平衡后测得各组分浓度如下:
CH3OH(g),达平衡后测得各组分浓度如下:
| 物质 | CO | H2 | CH3OH |
| 浓度(mol?L-1) | 0.9 | 1.0 | 0.6 |
②列式并计算平衡常数K=__________________________。
③若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是__________。
④若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正___v逆(填“>”、“<”或“=”)。
 +10H+=5Fe3++Mn2++5H2O)
+10H+=5Fe3++Mn2++5H2O)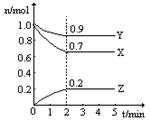
 2SO3 测得平衡时混合物总物质的量为5mol,求:
2SO3 测得平衡时混合物总物质的量为5mol,求: