题目内容
【题目】某小组同学用下图所示装置制取氨气 ,并探究其性质。
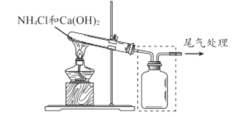
(1)上图试管中发生反应的化学方程式是____________________ 。
(2)请将上图方框中的收集装置补充完整__________________。
(3)下图是甲同学设计的尾气处理装置,乙同学认为该设计不合理,其理由是_______。
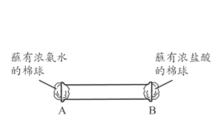
(4)下图所示,将蘸有浓氨水和浓盐酸的棉球分别塞到玻璃管两端的A、B 处,可观察到的现象是___________________。
(5)将上图反应后试管中固体溶于水得到溶液a , 取溶液 a 少许于试管中,_____(填操作和现象),则证明溶液 a 含有![]() 。
。
(6)工业合成氨为人类社会发展做出了巨大贡献。N2 和 H2在催化剂表面合成氨的微观历程及能最变化的示意图如下 ,用![]() )分别表示 N2 、H2 、NH3已知工业合成氨:N2(气)+ 3 H2(气)
)分别表示 N2 、H2 、NH3已知工业合成氨:N2(气)+ 3 H2(气)![]() 2NH3 ( 气)是一个放热反应下列说法正确的是 _________________。
2NH3 ( 气)是一个放热反应下列说法正确的是 _________________。
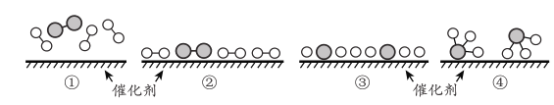
a.使用催化剂,可以加快合成氨的反应速率
b.②→③过程,是吸热过程且只有H - H 键的断裂
c.③→④过程,N 原 子和 H 原子形成了含有极性键的NH3
d.合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量
【答案】![]()
![]() 氨气极易溶于水,需用防倒吸装置 A、B两端呈白雾,玻璃管中央会产生白烟 向a溶液中加入强碱NaOH溶液后微热,并用湿润的红色石蕊试纸检验生成的气体,试纸变蓝说明原溶液含有
氨气极易溶于水,需用防倒吸装置 A、B两端呈白雾,玻璃管中央会产生白烟 向a溶液中加入强碱NaOH溶液后微热,并用湿润的红色石蕊试纸检验生成的气体,试纸变蓝说明原溶液含有![]() ac
ac
【解析】
(1)上图试管中发生的是实验室制备氨气的反应,其化学方程式为:![]() ,故答案为:
,故答案为:![]() 。
。
(2)由于氨气的密度比空气的小,故需用向下排空气法,采用上图装置收集则需短进长出,故上图方框中补充完整的收集装置如下:![]() ,故答案为:
,故答案为:![]()
(3)由于氨气极易溶于水,故尾气吸收时需防倒吸,故下图设计的尾气处理装置不合理,需接一个倒扣的漏斗,故其理由是氨气极易溶于水,需用防倒吸装置,故答案为:氨气极易溶于水,需用防倒吸装置;
(4) 由于浓氨水和浓盐酸都有很强的挥发性,挥发出来的NH3和HCl在玻璃管的中央发生反应:NH3+HCl=NH4Cl,产生NH4Cl固体小颗粒,故形成白烟,可观察到的现象是A、B两端呈白雾,玻璃管中央会产生白烟,故答案为:A、B两端呈白雾,玻璃管中央会产生白烟;
(5)将上图反应后试管中固体可能含有过量的NH4Cl,实验室检验![]() 的方法为:向a溶液中加入强碱NaOH溶液后微热,并用湿润的红色石蕊试纸检验生成的气体,试纸变蓝说明原溶液含有
的方法为:向a溶液中加入强碱NaOH溶液后微热,并用湿润的红色石蕊试纸检验生成的气体,试纸变蓝说明原溶液含有![]() ,故答案为:向a溶液中加入强碱NaOH溶液后微热,并用湿润的红色石蕊试纸检验生成的气体,试纸变蓝说明原溶液含有
,故答案为:向a溶液中加入强碱NaOH溶液后微热,并用湿润的红色石蕊试纸检验生成的气体,试纸变蓝说明原溶液含有![]() ;
;
(6) a.使用催化剂,降低反应所需要的活化能,可以加快合成氨的反应速率,a正确;
b.断裂化学键均需吸收能量,故②→③过程,是吸热过程,但包括H - H 键和N≡N键的断裂,b错误;
c.由图中可知,不同非金属原子之间形成的共价键是极性共价键,故③→④过程,N 原 子和 H 原子形成了含有极性键的NH3,c正确;
d.合成氨反应是放热反应,故反应物断键吸收能量小于生成物形成新键释放的能量,d错误;
故答案为:ac。

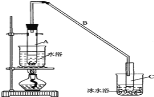
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
已知: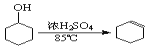 +H2O
+H2O
(1)制备粗品:将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是__,导管B除了导气外还具有的作用是__。
②试管C置于冰水浴中的目的是__。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在__层(填“上”或“下”),分液后用__(填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②如再将环己烯进行蒸馏,冷却水应从__口进入(填“上”或“下”)。