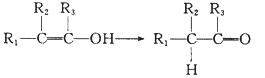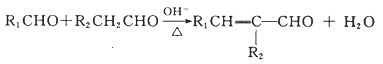��Ŀ����
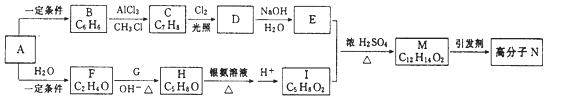
����Ŀ����CH2=C(CH3)2��![]() Ϊԭ�Ͽ��Ʊ�����E(C11H12O2),��ϳ�·������:
Ϊԭ�Ͽ��Ʊ�����E(C11H12O2),��ϳ�·������:
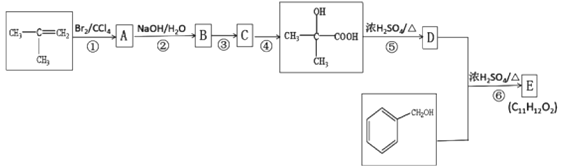
��֪C �ܷ���������Ӧ,D��ʹ���Ը��������Һ��ɫ����ش���������:
(1) ����ϵͳ�������л���CH2=C(CH3)2������Ϊ___________��
(2) C ���ܷ���������Ӧ�Ĺ�����������___________��
(3) �ݵķ�Ӧ������_________��
(4) д����Ӧ�Ļ�ѧ����ʽ:__________________��
(5) ��������![]() ��ͬ���칹����______��(������
��ͬ���칹����______��(������![]() )�����к˴Ź�������ͼ��4 �M��������FeCl3��Һ������ɫ��Ӧ���л���Ľṹ��ʽΪ________��
)�����к˴Ź�������ͼ��4 �M��������FeCl3��Һ������ɫ��Ӧ���л���Ľṹ��ʽΪ________��
(6) ���������ϳ�·�����һ������ϩ�Ʊ����Ҷ����Ҷ����ĺϳ�·��(����ע����Ӧ����)______��
���𰸡� 2-����ϩ ȩ�� ��ȥ��Ӧ 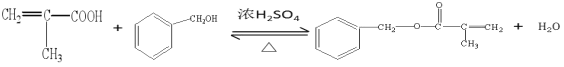 4
4 ![]()
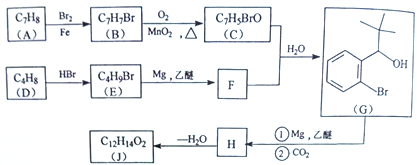
��������������������⿼���л��ƶϺ��л��ϳɡ����ؿ����л���������������ŵ�ʶ���л���Ӧ���͵��жϣ��л�����ʽ����д��������ͬ���칹����Ŀ��ȷ������д���л��ϳ�·�ߵ���ơ���Ӧ��Ϊ![]() ��Br2/CCl4�����ӳɷ�Ӧ����A��A�Ľṹ��ʽΪ
��Br2/CCl4�����ӳɷ�Ӧ����A��A�Ľṹ��ʽΪ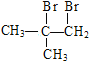 ����Ӧ��ΪA��NaOH/H2O����ˮ�ⷴӦ����B��B�Ľṹ��ʽΪ
����Ӧ��ΪA��NaOH/H2O����ˮ�ⷴӦ����B��B�Ľṹ��ʽΪ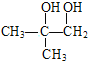 ��ͼʾ��Ӧ������ΪB��C��
��ͼʾ��Ӧ������ΪB��C��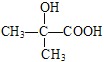 ��C�ܷ���������Ӧ��C�к�ȩ������Ӧ��������Ϊ������Ӧ��C�Ľṹ��ʽΪ
��C�ܷ���������Ӧ��C�к�ȩ������Ӧ��������Ϊ������Ӧ��C�Ľṹ��ʽΪ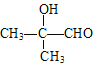 ��D��ʹ����KMnO4��Һ��ɫ����Ӧ��Ϊ��ȥ��Ӧ��D�Ľṹ��ʽΪ
��D��ʹ����KMnO4��Һ��ɫ����Ӧ��Ϊ��ȥ��Ӧ��D�Ľṹ��ʽΪ![]() �����ݷ�Ӧ����E�ķ���ʽ��C11H12O2������Ӧ��Ϊ������Ӧ��E�Ľṹ��ʽΪ
�����ݷ�Ӧ����E�ķ���ʽ��C11H12O2������Ӧ��Ϊ������Ӧ��E�Ľṹ��ʽΪ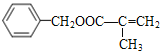 ��
��
��1��CH2=C��CH3��2��ϵͳ������ʾΪ![]() ������Ϊ2-����ϩ��
������Ϊ2-����ϩ��
��2��C�Ľṹ��ʽΪ ��C�й�����Ϊ�ǻ���ȩ����C���ܷ���������Ӧ�Ĺ����ŵ�����Ϊȩ����
��C�й�����Ϊ�ǻ���ȩ����C���ܷ���������Ӧ�Ĺ����ŵ�����Ϊȩ����
��3����Ϊ��ȥ��Ӧ��
��4����Ӧ��ΪD��![]() ��������Ӧ����Ӧ�Ļ�ѧ����ʽΪ
��������Ӧ����Ӧ�Ļ�ѧ����ʽΪ![]() +
+![]()
![]()
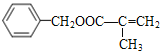 +H2O��
+H2O��
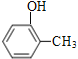
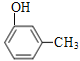
��5��![]() �еĹ�����Ϊ���ǻ������以Ϊͬ���칹��ĺ����������ʿ���Ϊ�ѡ��ӣ���������ͬ���칹��Ľṹ��ʽΪ
�еĹ�����Ϊ���ǻ������以Ϊͬ���칹��ĺ����������ʿ���Ϊ�ѡ��ӣ���������ͬ���칹��Ľṹ��ʽΪ![]() ��
�� ��
�� ��
��![]() ����4�������к˴Ź���������4���������FeCl3��Һ������ɫ��Ӧ���л���Ľṹ��ʽΪ
����4�������к˴Ź���������4���������FeCl3��Һ������ɫ��Ӧ���л���Ľṹ��ʽΪ![]() ��
��
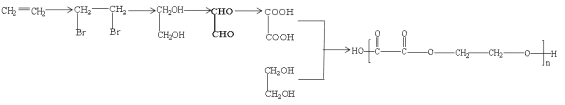
��6�����Ҷ����Ҷ����Ľṹ��ʽΪ![]() ���ϳɾ��Ҷ����Ҷ����ĵ���ΪHOOC��COOH��HOCH2CH2OH��HOOC��COOH��HOCH2CH2OH������2��̼ԭ���Һ�˫�����ţ�������CH2=CH2����Br2/CCl4�����ӳɷ�Ӧ����BrCH2CH2Br��BrCH2CH2Br����ˮ�ⷴӦ�õ�HOCH2CH2OH��HOCH2CH2OH��������������Ӧ�õ�HOOC��COOH���ϳ�·�߱�ʾΪ��
���ϳɾ��Ҷ����Ҷ����ĵ���ΪHOOC��COOH��HOCH2CH2OH��HOOC��COOH��HOCH2CH2OH������2��̼ԭ���Һ�˫�����ţ�������CH2=CH2����Br2/CCl4�����ӳɷ�Ӧ����BrCH2CH2Br��BrCH2CH2Br����ˮ�ⷴӦ�õ�HOCH2CH2OH��HOCH2CH2OH��������������Ӧ�õ�HOOC��COOH���ϳ�·�߱�ʾΪ��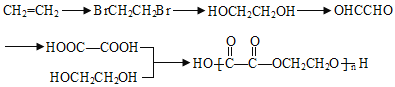 ��
��

����Ŀ�����Ƕ�ֲ����������ȱ�ٵ�Ԫ�أ�������Ȼ���е�ѭ������������Ҫ���塣��ѭ��ʾ��ͼ����:
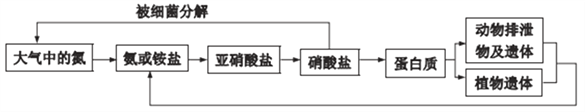
(1) �����ӵĵ���ʽ��__________��
(2) NH3����Ҫ�Ļ���ԭ�ϣ���;�㷺����ϳ����صȡ��ϳ�����ԭ��������:
CO2(g)+ 2NH3(g)=NH2COONH4(s) ��H1=- 159.5kJ/mol
NH2COONH4(s) = CO(NH2)2(s) + H2O(g) ��H2=+28.5kJ/mol
��2NH3(g)+ CO2(g)=CO(NH2)2(s) + H2O(g) ��H=_______kJ/mol
(3) �Ȼ��Ҳ�ǰ�����Ҫ���������25��ʱijŨ�ȵ��Ȼ����Һ��NH3��H2O��NH4+��Ũ����pH�ı仯ʾ��ͼ��ͼI��ʾ����ͼ�����ߢٴ�������__________[��c(NH3��H2O)��c(NH4+)]���¶���NH3��H2O ����ƽ�ⳣ��Ϊ___________(��a �Ĵ���ʽ��ʾ)��
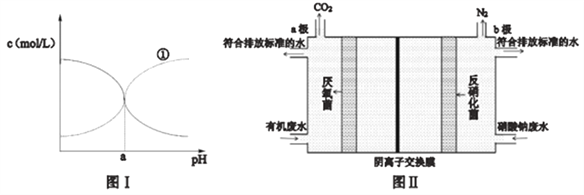
(4) �����������£������е�ijЩ����(ϸ��)�ɽ������λ�ԭ�ɵ�����ʵ����Ȼ���еĵ�ѭ����ij�о���ѧϰС��������Ȼ���еĵ�ѭ������������:������������ý���ѧ��ת��Ϊ���ܼ���Ƴ���������ͬʱ�����������ƺ��л���ķ�ˮ��װ��ԭ����ͼII(ͼ���л�����C6H12O6��ʾ).д���缫b�ϵĵ缫��Ӧʽ__________________��
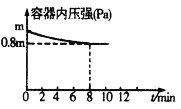
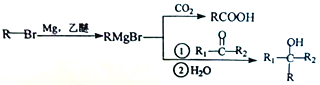
(5) ������̬�ĵ�ת��Ϊ����̬�ĵ��������Ĺ̶�������һ����Ҫ���˹��̵����Ǻϳɰ�����ά���¶�ΪTѹǿΪP�������£���һ�ݻ��ɱ���ܱ�������ͨ��1molN2��3molH2����N2(g) +3H2(g)![]() 2NH3(g)�ķ�Ӧ�������ݻ��뷴Ӧʱ������ݹ�ϵ���±�:
2NH3(g)�ķ�Ӧ�������ݻ��뷴Ӧʱ������ݹ�ϵ���±�:
ʱ��/min | 0 | 5 | 10 | 20 | 40 | 80 |
���� �ݻ�/L | 4.00V | 3.20V | 2.80V | 2.60V | 2.50V | 2.50V |
�������´�ƽ��ʱH2��ת���ʦ�(H2)=______��ƽ�ⳣ��K=_________(��V��ʾ)
����Ŀ���±���A��B��C��D�����л�����й���Ϣ��
A | ����ʹ������Ȼ�̼��Һ��ɫ���ڱ���ģ��Ϊ ������ˮ��һ�������·�Ӧ�����л���C |
B | ����C��H����Ԫ����ɣ������ģ��Ϊ |
C | ����C��H��O����Ԫ����ɣ�������Na��Ӧ����������NaOH��Һ��Ӧ������Cu�������Ҽ�������������O2��Ӧ |
D | ����C��H��O����Ԫ����ɣ������ģ��Ϊ ������C��Ӧ������Է�������Ϊ100���� |
�ش��������⣺
��1��A��������Ȼ�̼��Һ��Ӧ���������������________________��
��2��д����һ�������£�A�����ۺϷ�Ӧ���ɸ߷��ӻ�����Ļ�ѧ����ʽ��_____________��
��3��B���������________(�����)��
����ɫ��ζҺ�塡���ж����۲�����ˮ�����ܶȱ�ˮ��������KMnO4��Һ����ˮ��Ӧ��ɫ ���κ������²���������Ӧ ������ˮ��Ϻ�Һ��ֲ����ϲ�ʳȺ�ɫ��
��4����B�Ʊ��������Ļ�ѧ����ʽ___________________________��
��5��C��ͭ�������Ҽ�������������������Ӧ�Ļ�ѧ����ʽ_________________��
��6��D�й����ŵ�����Ϊ__________________________��
��7��D��C��Ӧ��������Է�������Ϊ100�������÷�Ӧ�ķ�Ӧ����Ϊ____________���仯ѧ����ʽΪ______________________________________��
����Ŀ���ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о�������ȷ������ָ�����ϳɰ���Ӧ��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ�����
�� �ȣ����� | 360 | 440 | 520 |
Kֵ | 0.036 | 0.010 | 0.0038 |
��1�������ϱ����ݿ�֪�÷�Ӧ����H_____ 0����������������=��������������
�����д�ʩ������������ԭ��������_____������ţ���
a������ѹǿ�����ںϳɰ� b��ʹ�ú��ʵĴ��������ڿ������ɰ�
c����������Ҫ�����¶���500��C���� d����Ҫʹ�ù�����N2�����H2ת����
��2��0.2mol NH3����ˮ�����뺬��0.2mol H2SO4��ϡ��Һ��ȫ��Ӧ����Q kJ���������Ȼ�ѧ����ʽ��ʾ�䷴Ӧʽ��___________________________________��
��3������ʱ����a mol��������ˮ����ͨ��b mol�Ȼ��⣬��Һ���Ϊ1L����c��NH4+��=c��Cl��������һˮ�ϰ��ĵ���ƽ�ⳣ��Kb=_____����ab��ʾ����
��4��ԭ����H2��ͨ����Ӧ CH4��g��+H2O ��g��![]() CO��g��+3H2��g�� ��ȡ����֪�÷�Ӧ�У�����ʼ������е�
CO��g��+3H2��g�� ��ȡ����֪�÷�Ӧ�У�����ʼ������е�![]() �㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ����ͼ��ʾ��
�㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ����ͼ��ʾ��
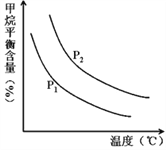
��ͼ�У��������߱�ʾѹǿ�Ĺ�ϵ�ǣ�P1_____P2��������������=��������������
����������һ���������¶ȣ������IJ��ʻ�______������������������С����С�������������䣩��
��5��ԭ����H2����ͨ����ӦCO��g��+H2O��g��![]() CO2��g��+H2��g����ȡ��
CO2��g��+H2��g����ȡ��
��T��ʱ�����ݻ��̶�Ϊ5 L�������г���1mol H2O��g����1mol CO�� ��Ӧ��ƽ����CO��Ũ��0.08 mol/L�����¶��·�Ӧ��ƽ�ⳣ��KֵΪ_____��
�ڱ����¶���ΪT�����ݻ����Ϊ5L���ı�ˮ������CO�ij�ʼ���ʵ���֮�ȣ������������з�Ӧ�����������ܹ�˵����ϵ����ƽ��״̬����_____������ţ���
a��������ѹǿ����ʱ��ı�
b�����������ܶȲ���ʱ��ı�
c����λʱ��������a mol CO2��ͬʱ����a mol H2
d���������n��CO����n��H2O����n��CO2����n��H2��=1��16��6��6