题目内容
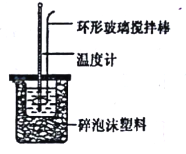
【题目】I.实验室用50 mL 0.50mol/L盐酸、50mL 0.55 mol/LNaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
完成下列问题:
(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是____。
(2)在操作正确的前提下,提高中和热制定准确性的关键是____.
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=____[盐酸和NaOH溶液的密度按1g/cm3计算,反应后混合溶液的比热容(c)按4.18J/(g.℃)计算].
(4)如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将_____(填“偏大”、“偏小”、“不变”).如改用60 mL0.5moI/L的盐酸与50 mL 0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等”或“不相等”),所求中和热_____(填“相等”或“不相等”)。
(5)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是______________。
A.测量盐酸的温度后,温度计没有用水冲洗干净
B. 把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F大烧杯的盖扳中间小孔太大。
Ⅱ.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过褪色所需时间来判断反应的快慢。该小组设计了如下方案:
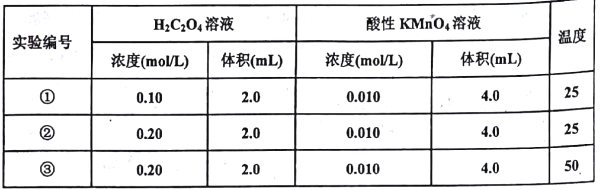
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4) ≥_______。
(2)试验编号②和③探究的内容是_____________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时同内平均反应速率v(KMnO4)=__________mol·L-1·min-1。
【答案】 Cu传热快,热量损失大 提高装置的保温效果 -56.8 kJ·mol-1 偏大 不相等 相等 ABDF 2.5(或5:2) 其他条件不变,温度对反应速率的影响 0.010
【解析】I.(1)不能将环形玻璃搅拌棒改为铜丝搅拌棒,因为铜丝搅拌棒是热的良导体;故答案为:Cu传热快,热量损失大;
(2)中和热测定实验主要目的是测量反应放出的热量多少,所以提高中和热测定准确性的关键是提高装置的保温效果; 故答案为:提高装置的保温效果;
(3)第1次实验盐酸和NaOH溶液起始平均温度为20.25℃,反应前后温度差为:3.45℃;第2次实验盐酸和NaOH溶液起始平均温度为20.40℃,反应前后温度差为:3.40℃;第3次实验盐酸和NaOH溶液起始平均温度为21.55℃,反应前后温度差为:3.35℃;三次温度差的平均值为3.40℃,50mL0.50molL-1盐酸、50mL0.55molL-1NaOH溶液的质量m=100mL×1g/mL=100g,c=4.18J/(g℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g℃)×100g×3.40℃=1421.2J=1.4212KJ,即生成0.025mol的水放出热量1.4212KJ,所以生成1mol的水放出热量为![]() =56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol;故答案为:-56.8kJ/mol;
=56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol;故答案为:-56.8kJ/mol;
(4)氢氧化钠固体溶于水放热,反应后温度偏高,计算所得热量偏大,所以实验中测得的“中和热”数值将偏大;反应放出的热量和所用酸以及碱的量的多少有关,改用60mL0.50mol/L盐酸跟50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,中和热相等;故答案为:偏大;不相等;相等;
(5)A.测量盐酸的温度后,温度计没有用水冲洗干净,在测碱的温度时,会发生酸和碱的中和,温度计示数变化值减小,所以导致实验测得中和热的数值偏小,故A正确;B、把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓,会导致一部分能量的散失,实验测得中和热的数值偏小,故B正确;C、做本实验的室温和反应热的数据之间无关,故C错误;D、将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水,由于氨水是弱碱,弱碱电离要吸热,导致实验测得中和热的数值偏小,故D正确;E、在量取盐酸时仰视计数,会使得实际量取体积高于所要量的体积,算过量,可以保证碱全反应,导致实验测得中和热的数值偏高,故E错误;F、大烧杯的盖板中间小孔太大,会导致一部分能量散失,导致实验测得中和热的数值偏小,故F正确;故选ABDF;
Ⅱ.(1)根据反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑;H2C2O4中碳元素的化合价为+3价,变成二氧化碳后化合价总共升高了2×(4-3)价,所以每消耗1mol H2C2O4转移2mol电子;为了观察到紫色褪去,高锰酸钾的物质的量应该少量,即c(H2C2O4):c(KMnO4)≥![]() =2.5,故答案为:2.5;
=2.5,故答案为:2.5;
(2)实验②和③,其他条件完全相同,探究的温度不同,因此探究了温度对反应速率的影响,故答案为:其他条件不变,温度对反应速率的影响;
(3)草酸的物质的量为:0.10molL-1×0.002L=0.0002mol,高锰酸钾的物质的量为:0.010molL-1×0.004L=0.00004mol,草酸和高锰酸钾的物质的量之比为:0.0002mol:0.00004mol=5:1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为: ![]() =
=![]() ×0.010mol/L,这段时间内平均反应速率v(KMnO4)=
×0.010mol/L,这段时间内平均反应速率v(KMnO4)=  =
=  molL-1s-1=
molL-1s-1= ×60 molL-1min-1=0.010molL-1min-1,故答案为:0.010。
×60 molL-1min-1=0.010molL-1min-1,故答案为:0.010。

 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案