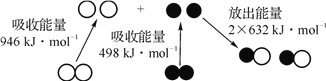
题目内容
【题目】如表所示为元素周期表的一部分,参照元素①~⑩在表中的位置,请回答下列问题: 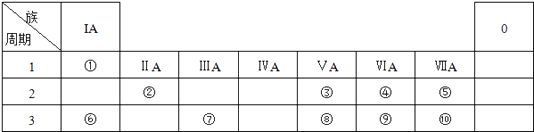
(1)写出①和④两种元素原子按1:1组成的常见化合物的电子式
(2)用电子式表示⑥和⑨形成化合物的过程:
(3)③、⑧、⑩的最高价氧化物对应水化物的酸性由强到弱的顺序为(用化学式表示).
(4)已知周期表中存在对角相似规则,如②与⑦在周期表中处于对角线位置则化学性质相似,②的氧化物、氢氧化物也有两性,写出②的氢氧化物与⑥的氢氧化物反应的化学方程式 .
(5)⑤、⑥、⑩的离子半径由大到小的顺序为(用离子符号表示).
【答案】
(1)![]()
(2)![]()
(3)HClO4>HNO3>H3PO4
(4)Be(OH)2+2NaOH=Na2BeO2+2H2O
(5)Cl﹣>F﹣>Na+
【解析】解:由元素在周期表中位置,可知①是H,②是Be,③是N,④是O,⑤是F,⑥是Na,⑦是Al,⑧是P,⑨是S,⑩是Cl.
(1.)①和④两种元素原子按1:1组成的常见化合物为过氧化氢,其电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;
;
(2.)⑥和⑨形成化合物为硫化钠,为离子化合物,用电子式表示⑥和⑨形成化合物的过程为 ![]() ,
,
所以答案是: ![]() ;
;
(3.)非金属性越强,对应最高价氧化物对应水化物的酸性越强,③、⑧、⑩的最高价氧化物对应水化物的酸性由强到弱的顺序为HClO4>HNO3>H3PO4 , 所以答案是:HClO4>HNO3>H3PO4;
(4.)②的氢氧化物与⑥的氢氧化物反应,生成偏铍酸钠、水,反应方程式为Be(OH)2+2NaOH=Na2BeO2+2H2O,所以答案是:Be(OH)2+2NaOH=Na2BeO2+2H2O;
(5.)电子层越多,离子半径越大;具有相同电子排布的离子,原子序数大的离子半径小,)⑤、⑥、⑩的离子半径由大到小的顺序为Cl﹣>F﹣>Na+ , 所以答案是:Cl﹣>F﹣>Na+ .

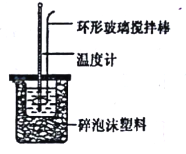
【题目】I.实验室用50 mL 0.50mol/L盐酸、50mL 0.55 mol/LNaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
完成下列问题:
(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是____。
(2)在操作正确的前提下,提高中和热制定准确性的关键是____.
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=____[盐酸和NaOH溶液的密度按1g/cm3计算,反应后混合溶液的比热容(c)按4.18J/(g.℃)计算].
(4)如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将_____(填“偏大”、“偏小”、“不变”).如改用60 mL0.5moI/L的盐酸与50 mL 0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等”或“不相等”),所求中和热_____(填“相等”或“不相等”)。
(5)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是______________。
A.测量盐酸的温度后,温度计没有用水冲洗干净
B. 把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F大烧杯的盖扳中间小孔太大。
Ⅱ.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过褪色所需时间来判断反应的快慢。该小组设计了如下方案:
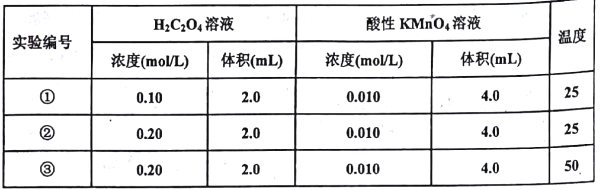
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4) ≥_______。
(2)试验编号②和③探究的内容是_____________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时同内平均反应速率v(KMnO4)=__________mol·L-1·min-1。