题目内容
19.NH3与灼热的CuO反应,生成N2,Cu和化合物A.(1)推断A的化学式;
(2)写出反应化学方程式,并标明电子转移的方向和数目.
(3)当有17g还原剂发生反应时,求消耗氧化剂的质量.
分析 (1)NH3与灼热的CuO反应,生成N2,Cu和化合物A,根据元素守恒知,A为H2O;
(2)该反应中N元素化合价由-3价变为0价、Cu元素化合价由+2价变为0价,转移电子数是6,所以该反应方程式为2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3H2O+3Cu;
(3)该反应中氨气失电子作还原剂,CuO得电子作氧化剂,n(NH3)=$\frac{17g}{17g/mol}$=1mol,根据氨气和CuO之间的关系式计算消耗CuO的质量.
解答 解:(1)NH3与灼热的CuO反应,生成N2,Cu和化合物A,根据元素守恒知,A为H2O,答:A为H2O;
(2)该反应中N元素化合价由-3价变为0价、Cu元素化合价由+2价变为0价,转移电子数是6,所以该反应方程式为2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3H2O+3Cu,其转移电子方向和数目为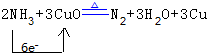 ,
,
答:其转移电子方向和数目为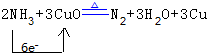 ;
;
(3)该反应中氨气失电子作还原剂,CuO得电子作氧化剂,n(NH3)=$\frac{17g}{17g/mol}$=1mol,根据氨气和CuO之间的关系式得消耗m(CuO)=$\frac{1mol}{2}×3×80g/mol$=120g,
答:消耗CuO的质量是120g.
点评 本题考查氧化还原反应有关计算,侧重考查学生分析计算能力,明确各个物理量之间的关系是解本题关键,难点是(2)题电子转移方向和数目的标注.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案
相关题目
9.据图判断下列说法正确的是( )


| A. | 图1中醋酸电离平衡常数:a点的比b点的小 | |
| B. | 图1中醋酸溶液的pH:a点的比b点的小 | |
| C. | 图2中c点对应的溶液为Fe(OH)3的不饱和溶液 | |
| D. | 由图2可知,欲除去CuSO4溶液中的Fe3+,可向溶液中加入CuO,调节pH约为4左右 |
10.一定温度下,某密闭容器中发生如下反应:A(g)+B(g)?C(g)+D(g)△H<0.当反应达到平衡时测得容器中各种物质均为amol.欲使C的平衡浓度增大一倍,在其他条件不变时,下列措施可采用的是( )
| A. | 降低温度 | B. | 恒容时,再通入2amolC和2amolD | ||
| C. | 恒压时,再通入2amolC和2amolD | D. | 恒容时,再通入amolA和amolB |
7.有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数之比为2:3:3,向溶液中通入氯气,使溶液中Cl-和Br-的个数比为7:3(已知还原性I->Fe2+>Br->Cl-),则通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比为( )
| A. | 5:4 | B. | 4:5 | C. | 5:12 | D. | 12:5 |
4.对于反应Zn+H2SO4═ZnSO4 +H2 (反应放热),下列叙述正确的是( )


| A. | 反应过程中的能量关系可用如图表示 | |
| B. | 1mol锌所含的能量高于1mol H2 所含的能量 | |
| C. | 若将其设计为原电池,则锌为正极 | |
| D. | 若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L |
19.下列化学反应方程式或离子方程式书写正确的是( )
| A. | 乙烯制溴乙烷:CH2CH2+Br2→CH2BrCH2Br | |
| B. | 乙醇催化氧化:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3COH+2H2O | |
| C. | 苯与氢气加成: +3H2$\stackrel{Ni}{→}$ +3H2$\stackrel{Ni}{→}$ (环己烷) (环己烷) | |
| D. | 从海带中提取碘:H2O2+2I-+2H+=I2+2H2O |