题目内容
3.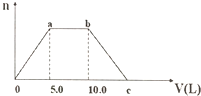 向Ba(OH)2和NaOH的混合溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体的体积(V)的关系如图所示,下列说法不正确的是( )
向Ba(OH)2和NaOH的混合溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体的体积(V)的关系如图所示,下列说法不正确的是( )| A. | a点之前的反应化学方程式为:CO2+Ba(OH)2=BaCO3↓+H2O | |
| B. | a~b之间的反应离子方程式为:CO2+2OH-=CO${\;}_{3}^{2-}$+H2O | |
| C. | c点CO2的体积应为15.0L | |
| D. | 原混合溶液中Ba(OH)2和NaOH的浓度之比为1:1 |
分析 向NaOH和Ba(OH)2的混合稀溶液中通入CO2,开始产生沉淀,故a点之前发生反应:CO2+Ba(OH)2=BaCO3↓+H2O,a~b之间先后发生的反应为:2NaOH+CO2═Na2CO3、Na2CO3+H2O+CO2═2NaHCO3,b~c之间发生反应:BaCO3+H2O+CO2═Ba(HCO3)2,由方程式可知生成碳酸钡沉淀与碳酸钡溶解消耗二氧化碳的体积相等,可知c点二氧化碳的体积,根据氢氧化钡、氢氧化钠消耗二氧化碳体积计算溶液中Ba(OH)2和NaOH的浓度之比.
解答 解:向NaOH和Ba(OH)2的混合稀溶液中通入CO2,开始产生沉淀,故a点之前发生反应:CO2+Ba(OH)2=BaCO3↓+H2O,a~b之间先后发生的反应为:2NaOH+CO2═Na2CO3、Na2CO3+H2O+CO2═2NaHCO3,b~c之间发生反应:BaCO3+H2O+CO2═Ba(HCO3)2.
A.由上述分析可知,a点之前发生反应:CO2+Ba(OH)2=BaCO3↓+H2O,故A正确;
B.a~b之间的反应:2NaOH+CO2═Na2CO3、Na2CO3+H2O+CO2═2NaHCO3,离子方程式为:2OH-+CO2═CO32-+H2O;CO32-+H2O+CO2═2HCO3-,故B错误;
C.由方程式可知生成碳酸钡沉淀与碳酸钡溶解消耗二氧化碳的体积相等,可知c点二氧化碳的体积为10L+5L=15L,故C正确;
D.氢氧化钡、氢氧化钠消耗二氧化碳体积分别为5L、5L,结合方程式可知,溶液中Ba(OH)2和NaOH的浓度之比为1:1,故D正确,
故选B.
点评 本题以化学反应图象形式考查反应方程式的有关计算,明确各阶段发生的反应是关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.若表为周期表的一部分,其中M的单质与水反应时,水作还原剂,下列说法正确的是( )
| Y | X | M | ||
| Z | W |
| A. | 最低价离子半径Y、X、M依次减小 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 工业上通过电解Z的氯化物来冶炼Z单质 | |
| D. | Y、W、X三种元素最低价氢化物的沸点依次升高 |
14.下列关于能量转换的认识中错误的是( )
| A. | 葡萄糖在人体组织中发生缓慢氧化时,热能转化为化学能 | |
| B. | 绿色植物进行光合作用时,太阳能转化为生物能 | |
| C. | 煤燃烧时,化学能主要转化为热能 | |
| D. | 电解水生成氢气和氧气时,电能转化为化学能 |
11.下列实验中,所选装置不合理的是( )
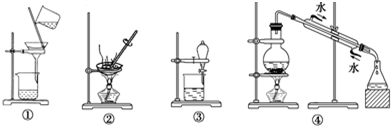

| A. | 分离Na2CO3溶液和CH3COOC2H5,选③ | |
| B. | 用CCl4提取碘水中的碘,选③和④ | |
| C. | 除去氯化钠中的少量硝酸钾固体,选②和① | |
| D. | 模拟血液透析,选① |
18.Al、Fe、Cu都是重要的金属元素.下列说法正确的是( )
| A. | FeCl2可通过化合反应一步制得 | |
| B. | 不能用稀盐酸区别二氧化锰、氧化铜、还原铁粉三种黑色粉末 | |
| C. | 采用将MgSO4溶液直接蒸干的方法不能制备MgSO4固体 | |
| D. | 可通过电解熔融MgCl2来制取Mg,故也可通过电解熔融的AlCl3来制取Al |
15.为了减少大气污染,许多城市推广汽车使用清洁燃料.目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG).这两类燃料的主要成分都是( )
| A. | 碳水化合物 | B. | 醇类 | C. | 氢气 | D. | 碳氢化合物 |
2.下列物质中,不含硅酸盐的是( )
| A. | 水玻璃 | B. | 硅芯片 | C. | 黏土 | D. | 普通水泥 |
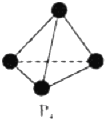 VA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态.含VA族元素的化合物在研究和生回答下列问题:
VA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态.含VA族元素的化合物在研究和生回答下列问题: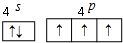 .N、P、As原子的第一电离能由大到小的顺序为N>P>As.
.N、P、As原子的第一电离能由大到小的顺序为N>P>As. .
.