题目内容
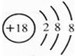
7.有A、B、C三种短周期主族元素,已知A元素的原子最外层电子数等于其电子层数,B元素的原子最外层电子数是其电子层数的2倍,C元素的原子最外层电子数是其电子层数的3倍.由三种元素组成的化合物的化学式不可能是( )| A. | A3BC4 | B. | A2(BC4)3 | C. | A2BC3 | D. | A2BC4 |
分析 有A、B、C三种短周期主族元素,A元素的原子最外层电子数等于其电子层数,所以A可能是H元素、Be元素、Al元素;B元素的原子最外层电子数是其电子层数的2倍,所以B可能是C元素、S元素;C元素的原子最外层电子数是其电子层数的3倍,原子只能有2个电子层,最外层电子数为6,所以C是O元素,结合常见物质化学式及化合价分析解答.
解答 解:有A、B、C三种短周期主族元素,A元素的原子最外层电子数等于其电子层数,所以A可能是H元素、Be元素、Al元素;B元素的原子最外层电子数是其电子层数的2倍,所以B可能是C元素、S元素;C元素的原子最外层电子数是其电子层数的3倍,原子只能有2个电子层,最外层电子数为6,所以C是O元素.
A.A表示+1、C表现-2价,化合物中各元素的化合价代数和为0,则A3BC4中B元素化合价为+5,不符合碳、硫元素化合价,故A错误;
B.可以形成Al2(SO4)3,该化学式符合A2(BC4)3,故B正确;
C.可以形成H2CO3、H2SO3等,该化学式符合A2BC3,故C正确.
D.可以形成H2SO4,化学式符合A2BC4,故D正确,
故选A.
点评 本题考查了元素位置结构关系的应用,难度中等,能正确判断元素是解本题的关键,注意利用列举法解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.下列各组物质各自形成的晶体,都属于分子晶体的化合物的是( )
| A. | H2O、HD、C3H8 | B. | P2O5、CO2、H3PO4 | C. | SO2、SiO2、CS2 | D. | CCl4、(NH4)2S、H2O2 |
18.若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈碱性,其原因可能是( )
| A. | 生成了一种弱酸强碱盐 | B. | 弱酸溶液和强碱溶液反应 | ||
| C. | 强酸溶液和弱碱溶液反应 | D. | 一元强酸溶液和二元强碱溶液反应 |
2.有人认为人体实际上是一架缓慢燃烧着的“高级机器”,人体在生命活动过程中也需要不断补充“燃料”,按照这种观点,人们通常摄入的下列物质不能看作“燃料”的是( )
| A. | 淀粉类物质 | B. | 水 | C. | 脂肪类物质 | D. | 蛋白质 |
16.下列说法中,正确的是( )
| A. | 分子组成相差一个或几个CH2原子团的物质互为同系物,它们有相似的化学性质和不同的物理性质 | |
| B. | 不带支链的烃,其分子是直线形的 | |
| C. | 甲烷是烷烃中碳含量最低的,也是组成最简单的烃 | |
| D. | 分子式为C4H10的烃有3种 |
10.饱和食盐水中加入碳酸氢铵可制备小苏打,滤出小苏打后,向母液中通入氨,再冷却、加食盐,过滤,得到氯化铵固体.下列分析错误的是( )
| A. | 该制备小苏打的方程式为:NaCl+NH4HCO3→NaHCO3↓+NH4Cl | |
| B. | 母液中通入的氨气与HCO3-反应:NH3+HCO3-→CO32-+NH4+ | |
| C. | 加食盐是为增大溶液中Cl-的浓度 | |
| D. | 由题可知温度较低时,氯化铵的溶解度比氯化钠的大 |
 .
. .
.
 .
.
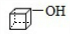
 ,G的结构简式是
,G的结构简式是 .
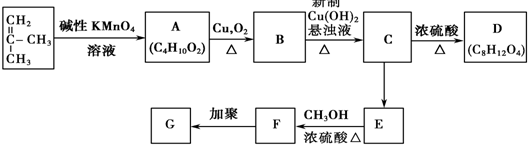
. +3Cu(OH)2$\stackrel{△}{→}$
+3Cu(OH)2$\stackrel{△}{→}$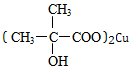 +Cu2O+4H2O.
+Cu2O+4H2O. +CH3OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3OH$→_{△}^{浓H_{2}SO_{4}}$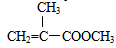 +H2O.
+H2O.