题目内容
9.关于甲醇碱性燃料电池的叙述正确的是( )| A. | 加入甲醇的电极是电池的正极 | |
| B. | 电池工作时氧气发生氧化反应 | |
| C. | 电池负极反应式为O2+4H++4e-═2H2O | |
| D. | 电池工作后电解质溶液碱性减弱 |
分析 甲醇碱性燃料电池中,负极上燃料甲醇失电子发生氧化反应CH4O+8OH--6e-=CO32-+6H2O,正极上氧化剂氧气得电子发生还原反应O2+4e-+2H2O=4OH-,根据电极反应式来判断.
解答 解:A、甲醇碱性燃料电池中,通入甲醇的电极是负极,故A错误;
B、甲醇碱性燃料电池中,正极上氧化剂氧气得电子发生还原反应,故B错误;
C、甲醇碱性燃料电池中,负极上燃料甲醇失电子发生氧化反应CH4O+8OH--6e-=CO32-+6H2O,故C错误;
D、电池工作的总反应:3O2+2CH4O+4OH-=2CO32-+6H2O,消耗氢氧根离子,所以电解质溶液碱性减弱,故D正确.
故选D.
点评 本题考查学生燃料电池的工作原理以及电极反应式的书写和应用,注意知识的归纳和梳理是解题的关键,难度不大.

练习册系列答案
相关题目
4.下列说法正确的是( )
| A. | 淀粉水解产物是CO2和H2O | B. | 油脂水解产物有氨基酸 | ||
| C. | 蔗糖与果糖互为同分异构体 | D. | 蛋白质是人类重要营养物质 |
14.胡椒酚的结构简式为: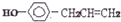 下列叙述中正确的是( )
下列叙述中正确的是( )
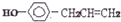 下列叙述中正确的是( )
下列叙述中正确的是( )| A. | 该分子中所有原子共面 | |
| B. | 该分子可与FeCl3溶液反应呈紫色 | |
| C. | 1mol该物质最多可与4molH2发生反应 | |
| D. | 1mol该分子最多可与4mol溴发生反应 |
1.某化学小组进行了硫代硫酸钠(Na2S2O3)的探究,首先通过查阅资料得到如下信息:a.Na2S2O3、BaS2O3均易溶于水;b.Na2S2O3晶体在空气中易被氧化.然后进行如下实验: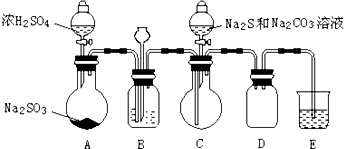
【实验一】硫代硫酸钠(Na2S2O3)的制取实验室制备装置如图所示(夹持装置已省略):
回答问题:
(1)①装置B中的长颈漏斗的作用是平衡压强.
②B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(2)在装置C中有Na2S2O3生成.
①写出装置C中反应的化学方程式:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2
②结束反应后,取C中溶液,经蒸发浓缩、冷却结晶、过滤洗涤、干燥,得到Na2S2O3•5H2O.
(3)装置E中为NaOH溶液.
【实验二】硫代硫酸钠(Na2S2O3)的性质
(4)Na2S2O3在酸性溶液中不能稳定存在.请用离子方程式表示该过程:2H++S2O32-=SO2↑+S↓+H2O
(5)如何检验Na2S2O3晶体在空气中已被氧化?少量Na2S2O3晶体于试管中,加适量水溶解,滴加少量的氯化钡溶液,如有白色沉淀生成,说明已被氧化.
【实验三】用Na2S2O3测定废水中的Ba2+
(6)工业上常用Na2S2O3溶液测定废水中Ba2+的浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量 K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过KI溶液,充分反应后得混合溶液V mL,将其平均分成4等份,加入淀粉溶液作指示剂,用0.001 00mol•L-1 的Na2S2O3溶液进行滴定,反应完全时,相关数据记录如表所示:
部分反应离子方程式为:
Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O;
I2+2S2O32-═2I-+S4O64-.
①判断达到滴定终点的现象是滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色,
②计算废水中Ba2+的物质的量浓度9.6×10-4mol•L-1.

【实验一】硫代硫酸钠(Na2S2O3)的制取实验室制备装置如图所示(夹持装置已省略):
回答问题:
(1)①装置B中的长颈漏斗的作用是平衡压强.
②B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(2)在装置C中有Na2S2O3生成.
①写出装置C中反应的化学方程式:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2
②结束反应后,取C中溶液,经蒸发浓缩、冷却结晶、过滤洗涤、干燥,得到Na2S2O3•5H2O.
(3)装置E中为NaOH溶液.
【实验二】硫代硫酸钠(Na2S2O3)的性质
(4)Na2S2O3在酸性溶液中不能稳定存在.请用离子方程式表示该过程:2H++S2O32-=SO2↑+S↓+H2O
(5)如何检验Na2S2O3晶体在空气中已被氧化?少量Na2S2O3晶体于试管中,加适量水溶解,滴加少量的氯化钡溶液,如有白色沉淀生成,说明已被氧化.
【实验三】用Na2S2O3测定废水中的Ba2+
(6)工业上常用Na2S2O3溶液测定废水中Ba2+的浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量 K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过KI溶液,充分反应后得混合溶液V mL,将其平均分成4等份,加入淀粉溶液作指示剂,用0.001 00mol•L-1 的Na2S2O3溶液进行滴定,反应完全时,相关数据记录如表所示:
| 实验编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准 溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O;
I2+2S2O32-═2I-+S4O64-.
①判断达到滴定终点的现象是滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色,
②计算废水中Ba2+的物质的量浓度9.6×10-4mol•L-1.
18.在同温同压下,下列各组热化学方程式中,△H1>△H2的是( )
| A. | 2H2(气)+O2(气)═2H2O(气)△H1 2H2(气)+O2(气)═2H2O(液)△H2 | |
| B. | S(气)+O2(气)═SO2(气)△H1 S(固)+O2(气)═SO2(气)△H2 | |
| C. | C(固)+O2(气)═CO2(气)△H1 C(固)+$\frac{1}{2}$O2 (气)═CO(气)△H2 | |
| D. | H2(气)+Cl2(气)═2HCl(气)△H1 $\frac{1}{2}$H2(气)+$\frac{1}{2}$Cl2(气)═HCl(气)△H2 |
 反应类型:加聚反应
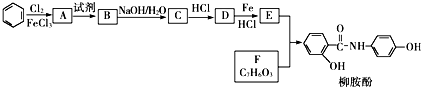
反应类型:加聚反应 反应类型:取代反应
反应类型:取代反应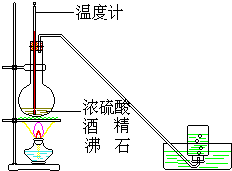 如图是实验室用乙醇与浓硫酸共热制乙烯的实验装置
如图是实验室用乙醇与浓硫酸共热制乙烯的实验装置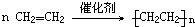 .
.
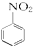 $→_{HCl}^{Fe}$
$→_{HCl}^{Fe}$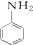
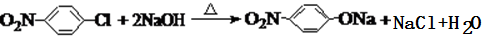 .
.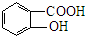 .
. 、
、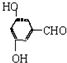 、
、 (写出2种).
(写出2种).