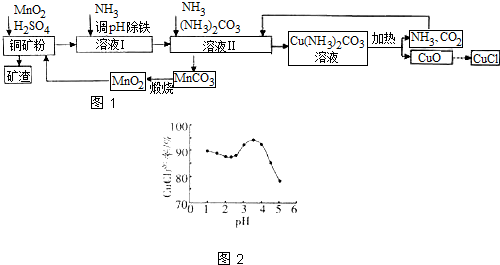
题目内容
17.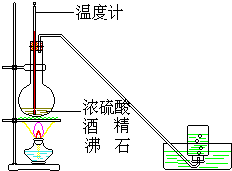 如图是实验室用乙醇与浓硫酸共热制乙烯的实验装置
如图是实验室用乙醇与浓硫酸共热制乙烯的实验装置(1)写出上述装置Ⅰ反应方程式CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,该反应属于消去反应
(2)温度计的作用是控制反应温度迅速升高到170度,如果温度控制不好极易发生副反应,方程式为2CH3CH2OH$→_{140℃}^{浓硫酸}$CH3CH2OCH2CH3+H2O
(3)沸石的作用是防止爆沸
(4)添加上述两液体试剂时,应先加乙醇
(5)若将制的乙烯通入溴的四氯化碳溶液时,方程式为Br2+CH2=CH2→BrCH2CH2Br
(6)乙烯的用途很多,可通过加聚反应生产塑料聚乙烯,写出该反应方程式:
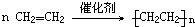 .
.
分析 (1)乙醇与浓硫酸在加热到170度,发生消去反应生成乙烯;
(2)实验室制备乙烯应控制温度迅速升高度170度,在140度容易发生分子间脱水生成乙醚;
(3)加热乙醇与浓硫酸混合液容易发生爆发;
(4)依据浓硫酸稀释正确操作解答;
(5)乙烯与溴发生加成反应生成1,2-二溴乙烷;
(6)乙烯发生加聚反应生成聚乙烯.
解答 解1)乙醇与浓硫酸在加热到170度,发生消去反应生成乙烯,化学方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;消去反应;
(2)实验室制备乙烯应控制温度迅速升高度170度,在140度容易发生分子间脱水生成乙醚,方程式:2CH3CH2OH$→_{140℃}^{浓硫酸}$CH3CH2OCH2CH3+H2O;
故答案为:控制反应温度迅速升高到170度;2CH3CH2OH$→_{140℃}^{浓硫酸}$CH3CH2OCH2CH3+H2O;
(3)加热乙醇与浓硫酸混合液容易发生爆发,应加入碎瓷片防止爆发;
故答案为:防止爆发;
(4)浓硫酸稀释产生大量的热,应将浓硫酸加入到乙醇中,所以应先加入乙醇,再加入浓硫酸;
故答案为:乙醇;
(5)乙烯与溴发生加成反应生成1,2-二溴乙烷,方程式:Br2+CH2=CH2→BrCH2CH2Br;
故答案为:Br2+CH2=CH2→BrCH2CH2Br;
(6)乙烯发生加聚反应生成聚乙烯,方程式: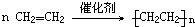 ;
;
故答案为: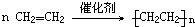 .
.
点评 本题考查了实验室制备乙烯及乙烯的性质,熟悉乙醇、乙烯的性质是解题关键,题目难度不大,注意实验条件的控制.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.下列实验中,分离提纯的方法不正确的是( )
| 选项 | 实验 | 分离、提纯方法 |
| A | 提纯粗苯甲酸 | 重结晶 |
| B | 分离乙醇和丁醇 | 蒸馏 |
| C | 除去乙炔中的H2S气体 | 用CuSO4溶液洗气 |
| D | 除去苯中的苯酚 | 加入NaOH溶液后过滤 |
| A. | A | B. | B | C. | C | D. | D |
5.硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2MgO•B2O3•H2O、SiO2及少量Fe3O4、CaCO3,Al2O3)为原料生产硼酸的工艺流程如图1:

已知:H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0g、8.7g、14.8g、40.2g.Fe3+、Al3 +、Fe2+和Mg2 +以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和 12.4.
(1)由于矿粉中含CaCO3,为防止“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施是:分批慢慢加入稀硫酸.
(2)“浸出液”显酸性,含H3BO3和Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质.“除杂”时向浸出液中依次加入适量H2O2和MgO,除去的杂质离子是Fe3+、Fe2+、Al3+.H2O2的作用是H2O2+2H++2Fe2+=2Fe3++2H2O (用离子方程式表示).
(3)“浸取”后,采用“热过滤”的目的是防止温度下降时H3BO3从溶液中析出.
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图2,且溶液的沸点随压强增大而升高.为了从“母液”中充分回收MgSO4•H20,应采取的 措施是将“母液”蒸发浓缩,加压升温结晶
(5)已知298K时,硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)?[B(OH)4]-(aq)+H+(aq) K=5.7×10-10
下列说法正确的是BD.
A.碳酸钠溶液滴入硼酸中能观察到有气泡产生
B.碳酸钠溶液滴入醋酸中能观察到有气泡产生
C.等浓度的碳酸和硼酸溶液比较,pH:前者>后者
D.等浓度的碳酸钠和醋酸钠溶液比较,pH:前者>后者.

已知:H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0g、8.7g、14.8g、40.2g.Fe3+、Al3 +、Fe2+和Mg2 +以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和 12.4.
(1)由于矿粉中含CaCO3,为防止“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施是:分批慢慢加入稀硫酸.
(2)“浸出液”显酸性,含H3BO3和Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质.“除杂”时向浸出液中依次加入适量H2O2和MgO,除去的杂质离子是Fe3+、Fe2+、Al3+.H2O2的作用是H2O2+2H++2Fe2+=2Fe3++2H2O (用离子方程式表示).
(3)“浸取”后,采用“热过滤”的目的是防止温度下降时H3BO3从溶液中析出.
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图2,且溶液的沸点随压强增大而升高.为了从“母液”中充分回收MgSO4•H20,应采取的 措施是将“母液”蒸发浓缩,加压升温结晶
(5)已知298K时,硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)?[B(OH)4]-(aq)+H+(aq) K=5.7×10-10
| 化学式 | 碳酸 | 醋酸 |
| 电离常数 | K1=4.4×10-7K2=4.7×10-11 | K=1.75×10-5 |
A.碳酸钠溶液滴入硼酸中能观察到有气泡产生
B.碳酸钠溶液滴入醋酸中能观察到有气泡产生
C.等浓度的碳酸和硼酸溶液比较,pH:前者>后者
D.等浓度的碳酸钠和醋酸钠溶液比较,pH:前者>后者.
9.关于甲醇碱性燃料电池的叙述正确的是( )
| A. | 加入甲醇的电极是电池的正极 | |
| B. | 电池工作时氧气发生氧化反应 | |
| C. | 电池负极反应式为O2+4H++4e-═2H2O | |
| D. | 电池工作后电解质溶液碱性减弱 |
6. 化学反应的快慢和限度对人类生产生活有重要的意义.
化学反应的快慢和限度对人类生产生活有重要的意义.
(1)将反应速率的影响条件填在空格处.
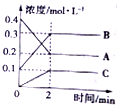
(2)800℃时,A、B、C三种气体在固定体积的密闭容器中反应,反应过程中各物质的浓度变化如图所示,分析图象回答问题:
①该反应的化学方程式为2A?2B+C;
(2)2min内,用C表示的反应速率为0.05mol/(L•min).
③在其他条件下,测得A的反应速率为0.05mol•L-1•min-1,此时的反应与800b℃时相比.
a.比800℃时快 b.比800℃时慢 c.与800℃时速率相等 d.无法确定
(3)判断该反应达到平衡状态的标志是ce
a.A和B的浓度相等
b.v(B)=2v(C)
c.容器内气体压强不再改变
d.密闭容器中混合气体的密度不变
e.容器内A的体积分数不再改变.
 化学反应的快慢和限度对人类生产生活有重要的意义.
化学反应的快慢和限度对人类生产生活有重要的意义.(1)将反应速率的影响条件填在空格处.
| 实例 | 影响条件 |
| ①食物放在冰箱里能延长保质期 | |
| ②工业炼铁时,把铁矿石预先粉碎后,再进行炼制 | |
| ③用H2O2分解制O2,加入MnO2 |
①该反应的化学方程式为2A?2B+C;
(2)2min内,用C表示的反应速率为0.05mol/(L•min).
③在其他条件下,测得A的反应速率为0.05mol•L-1•min-1,此时的反应与800b℃时相比.
a.比800℃时快 b.比800℃时慢 c.与800℃时速率相等 d.无法确定
(3)判断该反应达到平衡状态的标志是ce
a.A和B的浓度相等
b.v(B)=2v(C)
c.容器内气体压强不再改变
d.密闭容器中混合气体的密度不变
e.容器内A的体积分数不再改变.