题目内容
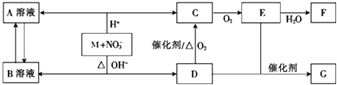
【题目】如图是一种钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,其作用是导电和隔膜,该电池反应为2Na+xS=Na2Sx . 该电池正极的电极反应式为 .
用该电池作电源进行铁件镀铜时,若电镀池中两电极的质量开始相同,电镀完成后取出洗净、烘干、称量,二者质量差为25.6g,则理论上该电池负极消耗的质量为g.
【答案】xS+2e﹣=Sx2﹣;9.2
【解析】解:原电池正极发生得电子的还原反应,在反应2Na+xS=Na2Sx中,硫单质得电子,故正极反应为:xS+2e﹣=Sx2﹣;电镀时,镀层作阳极、镀件作阴极,所以阳极上铜失电子发生氧化反应,电极反应式为Cu﹣2e﹣=Cu2+ , 阴极上铜离子得电子发生还原反应,阴极反应式为Cu2++2e﹣=Cu;电镀后,两个电极质量差等于阳极溶解质量与阴极析出质量之和,若电镀前铁、铜两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为25.6g,所以阳极溶解铜的质量为12.8g,
设通过的电子为x,
Cu | ﹣ | 2e﹣ | =Cu2+ |
64g | 2mol | ||
12.8g | x |
64g:2mol=12.8g:x,
x=0.4mol,
故流经电镀池的电极的电子的物质的量为0.4mol,而流经电镀池的电子的量与流经原电池中正负极的电子的量相同,设原电池负极上有Xg钠被消耗,有:
Na | ﹣ | e﹣ | =Na+ |
23g | 1mol | ||
Xg | 0.4mol |
可得 X= ![]()
解得X=9.2g
所以答案是:xS+2e﹣=Sx2﹣;9.2.

 中考解读考点精练系列答案
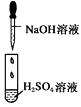
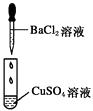
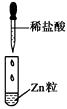
中考解读考点精练系列答案【题目】某同学在实验室中进行如下实验:
编号 | Ⅰ | Ⅱ | Ⅲ |
实验 |
|
|
|
现象 | 没有明显变化,溶液仍为无色 | 有白色沉淀生成,溶液为蓝色 | 有无色气体放出 |
以下结论正确的是( )
A.Ⅰ中无明显变化,说明两溶液不反应
B.Ⅱ中的白色沉淀为CuCl2
C.Ⅲ中的离子方程式为2H++Zn=Zn2++H2↑
D.Ⅲ中发生的反应不是离子反应