题目内容
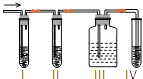
【题目】金属M在酸性或碱性溶液中均可与HNO3发生氧化还原反应,转化关系如图(部分生成物未列出): 
已知:C、D、E、G均为气体,且G为单质;将D通入A溶液产生白色沉淀;将F逐滴加入B溶液至过量,先产生白色沉淀,随后沉淀消失.
请回答下列问题:
(1)写出下列物质的化学式:M、F、G .
(2)A溶液与B溶液混合也能产生白色沉淀,写出该反应的离子方程式 .
(3)除去气体C中的气体E的化学方法是 .
(4)将10mL充满气体E和O2混合气的试管倒扣在水槽中,反应后试管中残留1mL无色气体,则试管中气体E的体积是mL
(5)D→C反应的化学方程式是 .
(6)M与NO3﹣在碱性条件下反应的离子方程式为 .
【答案】
(1)Al;HNO3;N2
(2)Al3++3AlO2﹣+6H2O=4Al(OH)3↓
(3)将气体通入水中,再用排水法收集
(4)8.6或7.2
(5)4NH3+5O2 ![]() 4NO+6H2O
4NO+6H2O
(6)8Al+3NO3﹣+5OH﹣+2H2O=8Al+3NH3↑
【解析】解:C、D、E、G均为气体,且G为单质,根据各物质转化关系,D能催化氧化得C,C氧化得E,D与E催化作用下生成G,则可推知D为NH3 , C为NO,E为NO2 , G为N2 , E与水反应生成F为HNO3 , 将F逐滴加入B溶液至过量,先产生白色沉淀,随后沉淀消失,则说明B中含有偏铝酸根,将D通入A溶液产生白色沉淀,说明A中含有铝离子,结合图中转化关系可知,M为Al,A为Al(NO3)3 , B为含AlO2﹣的溶液,(1)根据上面的分析可知,M为Al,F为HNO3 , G为N2 , 所以答案是:Al;HNO3;N2;(2)A溶液与B溶液混合也能产生白色沉淀为氢氧化铝,反应的离子方程式为Al3++3AlO2﹣+6H2O=4Al(OH)3↓,
所以答案是:Al3++3AlO2﹣+6H2O=4Al(OH)3↓; (3)由于二氧化氮与水反应能生成一氧化氮,所以除去气体NO中的气体NO2的化学方法是将气体通入水中,再用排水法收集,
所以答案是:将气体通入水中,再用排水法收集; (4)将10mL充满气体NO2和O2混合气的试管倒扣在水槽中,反应后试管中残留1mL无色气体可能为氧气,也可能为NO,当残留的为氧气时,则根据反应4NO2+O2+H2O=4HNO3 , 可知,参加反应的体积为 ![]() mL=7.2mL,当残留的为NO时,原反应剩余二氧化氮为3mL,则根据反应4NO2+O2+H2O=4HNO3 , 可知参加反应的二氧化氮为
mL=7.2mL,当残留的为NO时,原反应剩余二氧化氮为3mL,则根据反应4NO2+O2+H2O=4HNO3 , 可知参加反应的二氧化氮为 ![]() mL=5.6mL,则试管中NO2的总体积是5.6mL+3mL=8.6mL,
mL=5.6mL,则试管中NO2的总体积是5.6mL+3mL=8.6mL,
所以答案是:8.6或7.2; (5)D→C反应的化学方程式是4NH3+5O2 ![]() 4NO+6H2O,
4NO+6H2O,
所以答案是:4NH3+5O2 ![]() 4NO+6H2O; (6)Al与NO3﹣在碱性条件下反应的离子方程式为8Al+3NO3﹣+5OH﹣+2H2O=8Al+3NH3↑,
4NO+6H2O; (6)Al与NO3﹣在碱性条件下反应的离子方程式为8Al+3NO3﹣+5OH﹣+2H2O=8Al+3NH3↑,
所以答案是:8Al+3NO3﹣+5OH﹣+2H2O=8Al+3NH3↑.