题目内容
【题目】某课外活动小组用如图1所示装置进行实验,请回答下列问题: 
(1)若开始实验时开关K与a连接,则B极的电极反应式为 .
(2)若开始实验时开关K与b连接,则下列说法正确的是(填序号). ①溶液中Na+向A极移动
②从A极逸出的气体能使湿润的淀粉KI试纸变蓝
③反应一段时间后向电解液中加适量盐酸可恢复到电解前的浓度
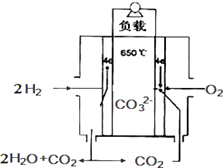
(3)该小组运用工业上离子交换膜法制烧碱的原理,用如图2所示装置电解K2SO4溶液. ①该电解槽的阳极反应式为 , 通过阴离子交换膜的离子数(填“>”、“<”或“=”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为;
③电解一段时间后,B口与C口产生气体的质量比为 .
【答案】
(1)Fe一2e﹣=Fe2+
(2)②
(3)4OH﹣﹣4e﹣=2H2O+O2↑;<;b<a<c<d;8:1
【解析】解:(1)若开始实验时开关K与a连接,铁为负极,发生铁的吸氧腐蚀,电极方程式为Fe一2e﹣=Fe2+ , 所以答案是:Fe一2e﹣=Fe2+;(2)若开始实验时开关K与b连接,形成电解池装置,A发生氧化反应生成氯气,使湿润的淀粉KI试纸变蓝,B发生还原反应生成氢气和氢氧化钠,阳离子向阴极移动,若回复到原来浓度,应通入HCl, 所以答案是:②;(3)①电解硫酸钾溶液,阳极发生氧化反应,OH﹣被氧化生成O2 , 电极方程式为,SO42﹣通过阴离子交换膜向阳极移动,钾离子通过阳离子交换膜向阴极移动,由电荷守恒知钾离子数目大于硫酸根离子数目,
所以答案是:4OH﹣﹣4e﹣=2H2O+O2↑;<;②OH﹣被氧化,阳极生成H+和O2 , pH减小,阴极发生还原反应生成H2和OH﹣ , pH增大,则pHb<a<c<d,所以答案是:b<a<c<d;③B口生成氧气,C生成氢气,物质的量之比为1:2,则质量之比为32:4=8:1,
所以答案是:8:1.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案