��Ŀ����
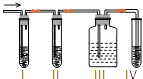
����Ŀ��ijѧ�������ͼ��ʾ��ʵ��װ�ã����������볱ʪ����ʯ�ҷ�Ӧ��ȡ����Ư�ۣ�����һ�����ȷ�Ӧ������ش��������⣺ 
��1�� A��B�еķ�Ӧ��ֱ���Ũ�����MnO2 �� д���������Ļ�ѧ����ʽ �� ����װ��C�������������������� ��
���𰸡�MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O| HCl| H2O
MnCl2+Cl2��+2H2O| HCl| H2O
��1��A��B�еķ�Ӧ��ֱ���Ũ�����MnO2 �� д���������Ļ�ѧ����ʽ �� ����װ��C�������������������� ��
��2��Ư�۵���Ч�ɷ������ѧʽ����D���������Ļ�ѧ��Ӧ�����ӷ���ʽ�� ��
��3����ʵ������Ư�۵�Ca��ClO��2����ƫ�ͣ���ѧ�����������������Ϸ��֣���Ҫԭ������U�ι��л�������������Ӧ�� ���¶Ƚϸ�ʱ��������ʯ�ҷ�Ӧ����Ca��ClO3��2 �� Ϊ����˸���Ӧ�ķ������ɲ�ȡ�Ĵ�ʩ��
��Ϊ������һ����Ӧ�ķ�����Ӧ��ȡ�Ĵ�ʩ�� ��
��4��������ʵ���в�����Cl2 �� ����ͨ��KI��Һ������������Һ�ȱ�ƺ����ɫ���ҿɼ�HIO3��д������ƽ�á�����ɫ����Ӧ�Ļ�ѧ����ʽ��5Cl2+I2+������KI��ΪKBr��Һ������Һ��Ϊɫ��δ��HBrO3�Ĵ��ڣ���������ʵ�Ʋ⣬Cl2��HIO3��HBrO3����������ǿ�����Ĵ����� ��
���𰸡�
��1��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O�� HCl�� H2O
MnCl2+Cl2��+2H2O�� HCl�� H2O
��2��Ca��ClO��2�� Cl2+2OH��=Cl��+ClO��+H2O
��3����U��������ˮԡ�У���B��C֮������һ��ʢ�б���ʳ��ˮ��ϴ��ƿ
��4��6H2O��2HIO3+10HCl���Ȼƣ� HBrO3��Cl2��HIO3
���������⣺��1��A��B�еķ�Ӧ��ֱ���Ũ�����MnO2�������Ļ�ѧ����ʽΪ��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O��Ũ�����ӷ����Ƶõ������л����Ȼ��������ˮ������
MnCl2+Cl2��+2H2O��Ũ�����ӷ����Ƶõ������л����Ȼ��������ˮ������
���Դ��ǣ�MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O��HCl��H2O����2��Ư�۵���Ч�ɷ�Ϊ�������Ca��ClO��2��D��Ϊ�������ƣ��������������������ӷ���ʽΪ��Cl2+2OH��=Cl��+ClO��+H2O��
MnCl2+Cl2��+2H2O��HCl��H2O����2��Ư�۵���Ч�ɷ�Ϊ�������Ca��ClO��2��D��Ϊ�������ƣ��������������������ӷ���ʽΪ��Cl2+2OH��=Cl��+ClO��+H2O��
���Դ��ǣ�Ca��ClO��2��Cl2+2OH��=Cl��+ClO��+H2O����3�����¶Ƚϸ�ʱ��������ʯ�ҷ�Ӧ������Ca��ClO3��2��Ϊ���⸱��Ӧ������Ӧ�ý����¶ȣ����Կ��Բ�ȡ��U��������ˮԡ�еĴ�ʩ��
���Դ��ǣ���U��������ˮԡ�У�
�������ӷ������ȹ��������ɵ������к����Ȼ��⣬�Ȼ����ܺͼӦ�����Է�Ӧ����ʽΪ��Ca��OH��2+2HCl=CaCl2+2H2O��Ϊ���⸱��Ӧ������������B��C֮������һ��ʢ�б���ʳ��ˮ��ϴ��ƿ��
���Դ��ǣ���B��C֮������һ��ʢ�б���ʳ��ˮ��ϴ��ƿ����4������Ŀ��Ϣ��֪��Cl2����Һ�е�I2������HIO3����������ԭΪHCl����Ӧ����ʽΪ��5Cl2+I2+6H2O=2HIO3+10HCl���ⱻ������������HIO3��˵��������Cl2��HIO3��KI��Һ����KBr��Һ���μ���ˮ����Һ�ʳȻ�ɫ���μ���ˮ����������ɫû�б仯����˵��������δ��HBrO3�Ĵ��ڣ��ܽ����һ��������˵��������HBrO3��Cl2������HBrO3��Cl2��HIO3��
���Դ��ǣ�6H2O��2HIO3+10HCl���Ȼƣ�HBrO3��Cl2��HIO3��

 ���б�ˢ��ϵ�д�
���б�ˢ��ϵ�д�