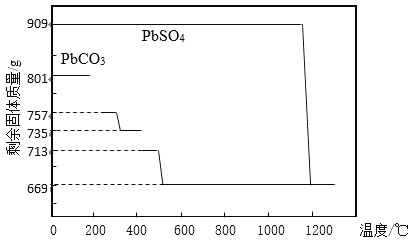
题目内容
【题目】向27.2 g Cu和Cu2O的混合物中加入某浓度的稀HNO3500 mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1 L 1 mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2 g。
(1)Cu与稀HNO3反应的离子方程式为__。
(2)Cu与Cu2O 的物质的量之比为__。
(3)HNO3的物质的量浓度为__mol·L-1。
【答案】3Cu+8H++![]() =3Cu2++2NO↑+4H2O 2∶1 2.4
=3Cu2++2NO↑+4H2O 2∶1 2.4
【解析】
Cu和Cu2O与稀硝酸反应生成硝酸铜,0.2molCu完全反应失去0.4mol电子,0.1molCu2O完全反应失去0.2mol电子,总共生成0.6mol电子,由电子守恒,生成NO的物质的量为![]() =0.2mol,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性,金属离子恰好完全沉淀,反应后的溶质为硝酸钠,则溶液中的硝酸根离子的物质的量为n(NO3-)=n(NaOH)=1mol/L×1L=1mol,则硝酸的总物质的量为1mol+0.2mol=1.2mol,根据c=
=0.2mol,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性,金属离子恰好完全沉淀,反应后的溶质为硝酸钠,则溶液中的硝酸根离子的物质的量为n(NO3-)=n(NaOH)=1mol/L×1L=1mol,则硝酸的总物质的量为1mol+0.2mol=1.2mol,根据c=![]() 进行计算。
进行计算。
①Cu与稀HNO3反应生成硝酸铜、一氧化氮和水,离子反应方程式:3Cu+8H++![]() =3Cu2++2NO↑+4H2O;
=3Cu2++2NO↑+4H2O;
②所得溶液中加入1.0 mol·L-1的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,溶液中溶质为NaNO3,n(NaNO3)=n(NaOH)=1.0 mol·L-1×1.0 L=1 mol,沉淀为Cu(OH)2,质量为39.2 g,物质的量为![]() =0.4 mol,根据铜元素守恒有n(Cu)+2n(Cu2O)=n[Cu(OH)2],所以反应后的溶液中n[[Cu(NO3)2]=n[Cu(OH)2]=0.4 mol,设Cu、Cu2O的物质的量分别为x、y,则
=0.4 mol,根据铜元素守恒有n(Cu)+2n(Cu2O)=n[Cu(OH)2],所以反应后的溶液中n[[Cu(NO3)2]=n[Cu(OH)2]=0.4 mol,设Cu、Cu2O的物质的量分别为x、y,则
![]()
解得x=0.2,y=0.1,所以Cu与Cu2O 的物质的量之比为2∶1;
③Cu和Cu2O与稀硝酸反应生成硝酸铜,0.2 mol Cu完全反应失去0.4 mol电子,0.1 mol Cu2O完全反应失去0.2 mol电子,总共失去0.6 mol电子,由电子守恒,生成NO的物质的量为![]() =0.2 mol,在所得溶液中加入1.0 mol·L-1的NaOH溶液1.0 L,此时溶液呈中性,金属离子恰好完全沉淀,反应后的溶质为硝酸钠,则溶液中的硝酸根离子的物质的量为n(
=0.2 mol,在所得溶液中加入1.0 mol·L-1的NaOH溶液1.0 L,此时溶液呈中性,金属离子恰好完全沉淀,反应后的溶质为硝酸钠,则溶液中的硝酸根离子的物质的量为n(![]() )=n(NaOH)=1 mol·L-1×1 L=1 mol,则硝酸的总物质的量为1 mol+0.2 mol=1.2 mol,硝酸的浓度为
)=n(NaOH)=1 mol·L-1×1 L=1 mol,则硝酸的总物质的量为1 mol+0.2 mol=1.2 mol,硝酸的浓度为![]() =2.4 mol·L-1。
=2.4 mol·L-1。