题目内容
【题目】将35g锌粉与少量浓硫酸在加热条件下充分反应,共收集到混合气体11.2L(标准状况),其质量为19.6g,则剩余锌粉的质量为
A. 1.0g B. 2.0g C. 2.5g D. 3.5g
【答案】C
【解析】试题分析:Zn与浓硫酸发生反应:Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O,当反应进行到一定程度后变为稀硫酸,这时发生反应:Zn+H2SO4(稀)= ZnSO4+H2↑。反应产生的气体为SO2、H2的混合物。二者的物质的量的和是n(H2)+n(SO2)=11.2L÷22.4L/mol=0.5mol;根据方程式可知反应消耗Zn的物质的量与反应产生的氢气的物质的量相等,n(气)=10.5mol,则反应消耗Zn的物质的量是0.5mol,消耗的Zn的质量是m(Zn)=nM=0.5mol×65g/mol=32.5g,所以反应后剩余的Zn 的质量是m=35g=32.5g=2.5g。
ZnSO4+SO2↑+2H2O,当反应进行到一定程度后变为稀硫酸,这时发生反应:Zn+H2SO4(稀)= ZnSO4+H2↑。反应产生的气体为SO2、H2的混合物。二者的物质的量的和是n(H2)+n(SO2)=11.2L÷22.4L/mol=0.5mol;根据方程式可知反应消耗Zn的物质的量与反应产生的氢气的物质的量相等,n(气)=10.5mol,则反应消耗Zn的物质的量是0.5mol,消耗的Zn的质量是m(Zn)=nM=0.5mol×65g/mol=32.5g,所以反应后剩余的Zn 的质量是m=35g=32.5g=2.5g。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】高炉炼铁过程中发生反应: ![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) ![]() Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如表,下列说法正确的是( )
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如表,下列说法正确的是( )
温度/°C | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
A.△H>0
B.1000℃时,在固定体积的密闭容器中,某时刻测得上述体系中,CO,CO2的物质的量分别为0.5mol、1.8mol,此时反应向正反应方向进行
C.其他条件不变,向平衡体系充入CO2气体,K值减小
D.其他条件不变,升高温度,可以提高CO的平衡转化率
【题目】(多选)等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到如图,则曲线a、b、c、d所对应的实验组别可能是( )
组别 | c(HCl)(mol/L) | 温度(℃) | 状态 |
1 | 2.0 | 25 | 块状 |
2 | 2.5 | 30 | 块状 |
3 | 2.5 | 50 | 块状 |
4 | 2.5 | 30 | 粉末状 |
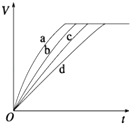
A.4﹣3﹣2﹣1
B.1﹣2﹣3﹣4
C.3﹣4﹣2﹣1
D.1﹣2﹣4﹣3