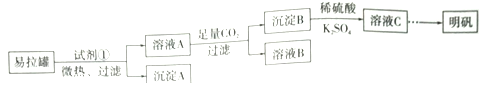
题目内容
【题目】如图是一个化学过程的示意图,回答下列问题: 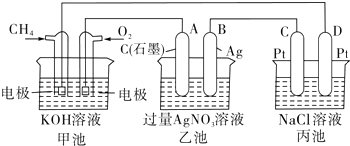
(1)甲池是装置,电极A的名称是 .
(2)甲装置中通入CH4的电极反应式为 , 乙装置中B(Ag)的电极反应式为 , 丙装置中D极的产物是(写化学式),
(3)一段时间,当丙池中产生112mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃时的pH= . (已知:NaCl溶液足量,电解后溶液体积为500mL).若要使丙池恢复电解前的状态,应向丙池中通入(写化学式).
【答案】
(1)原电池;阳极
(2)CH4+10OH﹣﹣8e﹣=CO32﹣+7H2O;Ag++e﹣=Ag;H2和NaOH
(3)12;HCl
【解析】解:(1)甲池中一极通入甲烷,另一极通入氧气,所以甲池为甲烷形成的燃料电池,通入甲烷的一极为负极,通入氧气的一极为正极,A与正极相连,所以A为阳极;所以答案是:原电池;阳极;(2)CH4在负极上失电子,碱性条件下生成碳酸根,所以甲装置中通入CH4的电极反应式为CH4+10OH﹣﹣8e﹣=CO32﹣+7H2O;乙装置中B(Ag)的电极为银离子得电子,其电极反应式为:Ag++e﹣=Ag;丙装置中D极为阴极,电极上水放电生成氢气和氢氧根离子,所以D极的产物是H2和NaOH;所以答案是:CH4+10OH﹣﹣8e﹣=CO32﹣+7H2O;Ag++e﹣=Ag;H2和NaOH;(3)设电解后氢氧化钠的物质的量浓度是xmol/L,丙池中产生112mL,则氢气的体积与氯气的体积相同均为56mL,
2NaCl+ | 2H2O |
| H2↑+ | Cl2↑+ | 2NaOH |
22.4L | 2mol | ||||
0.056L | 0.5xmol |
则x= ![]() =0.01mol/L
=0.01mol/L
则C(H+)=10﹣12 mol/L,所以溶液的pH=12,
由于电解生成H2和Cl2从溶液中逸出,所以应该加二者的化合物,即加入HCl,
所以答案是:12;HCl.