题目内容
【题目】称取铁粉和氧化铜的混合物6.40g,进行如下实验:
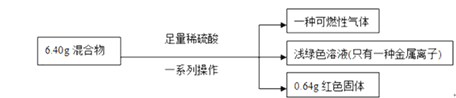
根据实验所得数据,完成下列填空:
(1)原混合物中氧化铜的质量能否确定?____________(填“能”或“不能”),若能确定,则氧化铜的质量为_________;
(2)上述过程中生成气体的名称为_________;(折算为标准状况下)的体积为__________ ;
(3)实验中参加反应的硫酸的物质的量为____________;
(4)原混合物中铁的质量分数为 ________。
【答案】 能 0.8g 氢气 2.016L 0.1mol 87.5%
【解析】生成可燃性气体,说明发生反应Fe+H2SO4=FeSO4+H2↑,溶液为浅绿色,只有一种金属离子,则发生CuO+H2SO4=CuSO4+H2O后,又发生CuSO4+Fe=FeSO4+Cu,且Cu被完全置换,生成0.64gCu,其物质的量: ![]() =0.01mol,由Cu元素守恒可知n(CuO)=n(Cu)=0.01mol,
=0.01mol,由Cu元素守恒可知n(CuO)=n(Cu)=0.01mol,
故混合物中:m(CuO)=0.01mol×80g/mol=0.8g,则:m(Fe)=6.40g-0.8g=5.6g,n(Fe)=![]() =0.1mol。(1)原混合物中氧化铜的质量能确定,氧化铜的质量为0.8g;(2)上述过程中生成气体的名称为氢气;设氢气的物质的量为nmol,根据电子转移守恒可得:2n+0.01mol×2=0.1mol×2,解得n=0.09mol,(折算为标准状况下)的体积为0.09mol×22.4L/mol=2.016L;(3)实验中参加反应的硫酸最终转化为硫酸亚铁,根据质量守恒可知,其物质的量等于铁的物质的量,则为0.1mol;(4)由上述分析可知,Fe的质量为5.6g,混合物中Fe的质量分数为:
=0.1mol。(1)原混合物中氧化铜的质量能确定,氧化铜的质量为0.8g;(2)上述过程中生成气体的名称为氢气;设氢气的物质的量为nmol,根据电子转移守恒可得:2n+0.01mol×2=0.1mol×2,解得n=0.09mol,(折算为标准状况下)的体积为0.09mol×22.4L/mol=2.016L;(3)实验中参加反应的硫酸最终转化为硫酸亚铁,根据质量守恒可知,其物质的量等于铁的物质的量,则为0.1mol;(4)由上述分析可知,Fe的质量为5.6g,混合物中Fe的质量分数为: ![]() ×100%=87.5%。
×100%=87.5%。