题目内容
16.下列关于物质用途的描述中错误的是( )| A. | 钾钠合金可以用于快中子反应堆的热交换剂 | |
| B. | MgO是优质的耐高温材料 | |
| C. | 铝合金密度小、强度高,可制成汽车车轮骨架和飞机构件 | |
| D. | 用钠和氯气反应制备氯化钠 |
分析 A.钠钾合金具有良好的导热性;
B.氧化镁熔点高,耐高温;
C.合金与组成它的各种成分相比,一般具有熔点低、硬度大、抗腐蚀性强等方面的特点;
D.钠价格昂贵.
解答 解:A.钠钾合金具有良好的导热性,能够用于快中子反应堆的热交换剂,故A正确;
B.氧化镁熔点高,耐高温,是良好的耐火材料,故B正确;
C.铝合金密度小、强度高,可制成汽车车轮骨架和飞机构件,故C正确;
D.钠价格昂贵,用来制备廉价的氯化钠,不符合经济原则,故D错误;
故选:D.
点评 本题考查了金属及合金的性质,熟悉合金的性质是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.下列有关化学用语、概念的表述中正确的是( )
| A. | 氢氧化钡溶液与硫酸铜溶液反应的离子方程式为Ba2++SO42-═BaSO4↓ | |
| B. | 氢气的燃烧热为285.8KJ/mol,所以表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H≈-571.6KJ/mol | |
| C. | 原子序数为1和8的两种元素形成的18电子的化合物的电子式为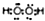 | |
| D. | 铜锌原电池的正极反应式一定为2H++2e-═H2↑ |
7.下列实验能获得成功的是( )
| A. | 将乙酸乙酯与NaOH溶液共热一段时间后,可看到分层消失 | |
| B. | 将苯逐滴滴入浓硝酸和稀硫酸的混合液中,并用沸水浴加热制取硝基苯 | |
| C. | 将铜丝在酒精灯外焰上加热后,再将铜丝转移至内焰,铜丝恢复原来的红色 | |
| D. | 淀粉用酸催化水解后的溶液加入新制银氨溶液,水浴加热,可看到有银镜出现 |
4.下列说法中正确的是( )
| A. | O2与O3互为同位素 | |
| B. | ${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O互为同素异形体 | |
| C. | 麦芽糖与蔗糖互为同分异构体 | |
| D. | CH3-CH2-CH2-CH3与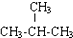 互为同系物 互为同系物 |
1.在元素周期表中,从左到右共有18个纵行.第1纵行(氢除外)为碱金属元素,稀有气体是第18纵行.下列说法中正确的是( )
| A. | 铝元素位于第3纵行,第ⅢA族 | |
| B. | 过渡元素在周期表中共占10个纵行,其中第Ⅷ族占8、9、10三个纵行 | |
| C. | 第17纵行都是非金属元素,所有元素的化合价都有+7价 | |
| D. | 第16纵行元素都是非金属元素 |
8.如图是我国化学家近年来合成的两种聚乙炔衍生物分子的结构式.
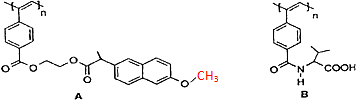
下列说法正确的是( )

下列说法正确的是( )
| A. | A和B均能在一定条件下水解,且水解均生成两种产物 | |
| B. | A水解生成的高分子化合物中所有碳原子一定共面 | |
| C. | A和B的链节中均含有2个以上手性碳原子 | |
| D. | 1molA和B各与热碱液反应,均最多消耗2n mol NaOH |
5.以元素化合价升降的观点分析下列各化学反应,其中不属于氧化还原反应的是( )
| A. | Mg+2HCl═MgCl2+H2↑ | B. | H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl | ||
| C. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | D. | CaCl2+Na2CO3═CaCO3↓+2NaCl |
6.下列说法不正确的是( )
| A. | 已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g),△H=+489.0 kJ/mol CO(g)+1/2O2(g)═CO2(g),△H=-283.0 kJ/mol C(石墨)+O2(g)═CO2(g),△H=-393.5 kJ/mol 则4Fe(s)+3O2(g)═2Fe2O3(s),△H=-1641.0 kJ/mol | |
| C. | 在0.1mol/L的氨水中加水稀释,氨水的导电能力降低 | |
| D. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,Ka=$\frac{(ca)^{2}}{c(1-a)}$.若加入少量醋酸钠固体,则CH3COOH?CH3COO-+H+向左移动,α减小,Ka变小 |