题目内容
6.下列说法不正确的是( )| A. | 已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g),△H=+489.0 kJ/mol CO(g)+1/2O2(g)═CO2(g),△H=-283.0 kJ/mol C(石墨)+O2(g)═CO2(g),△H=-393.5 kJ/mol 则4Fe(s)+3O2(g)═2Fe2O3(s),△H=-1641.0 kJ/mol | |
| C. | 在0.1mol/L的氨水中加水稀释,氨水的导电能力降低 | |
| D. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,Ka=(ca)2c(1−a).若加入少量醋酸钠固体,则CH3COOH?CH3COO-+H+向左移动,α减小,Ka变小 |
分析 A.冰是由水分子通过氢键形成的分子晶体,冰的熔化热为6.0kJ•mol-1,1mol冰变成0℃的液态水所需吸收的热量为6.0kJ,全用于打破冰的氢键,冰中氢键键能为20.0kJ•mol-1,1mol冰中含有2mol氢键,需吸收40.0kJ的热量;6.0kJ/40.0kJ×100%=15%;
B.Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g);△H=+489.0 kJ•mol-1…①
CO(g)+12O2(g)═CO2(g);△H=-283.0 kJ•mol-1…②
C(石墨)+O2(g)═CO2(g);△H=-393.5 kJ•mol-1…③
4Fe(s)+3O2(g)═2Fe2O3(s);△H=-1641.0 kJ•mol-1…④
根据盖斯定律,方程式4Fe(s)+3O2(g)═2Fe2O3(s)可由[(③-②)×6]-(①×2)可得△H;
C.在0.1mol/L的氨水中加水稀释,促进电离,体积增大,但离子浓度减小;
D.若加入少量醋酸钠固体,CH3COONa═CH3COO-+Na+增大了CH3COO-的浓度,CH3COOH?CH3COO-+H+向左移动,α减小,但醋酸的浓度比原先的大,分子分母中c变大,Ka不变.
解答 解:A.冰是由水分子通过氢键形成的分子晶体,冰的熔化热为6.0kJ•mol-1,1mol冰变成0℃的液态水所需吸收的热量为6.0kJ,全用于打破冰的氢键,冰中氢键键能为20.0kJ•mol-1,1mol冰中含有2mol氢键,需吸收40.0kJ的热量.6.0kJ/40.0kJ×100%=15%.由计算可知,最多只能打破1mol冰中全部氢键的15%,故A正确;
B.Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g);△H=+489.0 kJ•mol-1…①
CO(g)+12O2(g)═CO2(g);△H=-283.0 kJ•mol-1…②
C(石墨)+O2(g)═CO2(g);△H=-393.5 kJ•mol-1…③
4Fe(s)+3O2(g)═2Fe2O3(s);△H=-1641.0 kJ•mol-1…④
根据盖斯定律,方程式4Fe(s)+3O2(g)═2Fe2O3(s)可由[(③-②)×6]-(①×2)可得,
△H=[-393.5 kJ•mol-1-(-283.0 kJ•mol-1)]×6-(489.0 kJ•mol-1×2)=-1641.0 kJ•mol-1,故B正确;
C.在0.1mol/L的氨水中加水稀释,促进电离,体积增大,但离子浓度减小,所以氨水的导电能力降低,故C正确;
D.Ka是电离常数,是弱电解质达电离平衡时的平衡常数,在一定温度下,与浓度无关,Ka的计算用溶液中电离出来的各离子浓度乘积与溶液中未电离的电解质分子浓度的比值,一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,CH3COOH?CH3COO-+H+醋酸电离出的CH3COO-和H+浓度均为cα,溶液中未电离的电解质分子浓度为c(1-α),故题中Ka=(ca)2c(1−a);若加入少量醋酸钠固体,CH3COONa═CH3COO-+Na+增大了CH3COO-的浓度,CH3COOH?CH3COO-+H+向左移动,α减小,但醋酸的浓度比原先的大,分子分母中c变大,Ka不变,故D错误;
故选:D.
点评 本题是一道侧重考查化学基本理论知识的综合题,涉及氢键、电离平衡、盖斯定律等知识.做题时要正确理解这些概念的内涵.会运用盖斯定律进行计算.

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案| A. | 钾钠合金可以用于快中子反应堆的热交换剂 | |
| B. | MgO是优质的耐高温材料 | |
| C. | 铝合金密度小、强度高,可制成汽车车轮骨架和飞机构件 | |
| D. | 用钠和氯气反应制备氯化钠 |
| A. | 苯酚 | B. | CH3COOCH2CH2CH3 | C. | HCOOH | D. | CH3OH |
| A. | 醛基的电子式: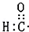 | B. | 三硝基甲苯的结构简式: | ||
| C. | 丙烷分子的比例模型: | D. | 2-乙基-1,3-丁二烯的键线式: |
| A. | 钠 | B. | 酸性高锰酸钾 | C. | 溴水 | D. | 新制氢氧化铜 |
| A. | 蛋白质水解的最终产物是多肽 | B. | 淀粉水解的最终产物是葡萄糖 | ||
| C. | 纤维素不能水解成葡萄糖 | D. | 油脂水解产物之一是乙醇 |
 如图所示是Zn和Cu形成的原电池,下列描述合理的是( )
如图所示是Zn和Cu形成的原电池,下列描述合理的是( )①Zn为负极,Cu为正极
②Cu极上有气泡产生
③阳离子移向Zn极
④电子从Zn极流出沿导线流向Cu极
⑤该装置能将电能转化为化学能
⑥若有0.5mol电子流经导线,则负极质量减轻16g.
| A. | ①②④ | B. | ②③ | C. | ④⑤⑥ | D. | ③④⑤ |
①BeCl2 ②NCl3 ③PCl5 ④COCl2 ⑤SF6 ⑥XeF2 ⑦CS2 ⑧CH4 ⑨CF2Cl2⑩S2Cl2.
| A. | ②④⑦⑧⑨⑩ | B. | ②④⑦⑨⑩ | C. | ③④⑦⑩ | D. | ④⑤⑦⑨⑩ |

| A. | 乙醇与钠反应,键①断裂 | |
| B. | 乙醇在Ag催化作用下与O2反应,键①③断裂 | |
| C. | 乙醇完全燃烧时,只有①②键断裂 | |
| D. | 乙醇、乙酸和浓硫酸共热制乙酸乙酯,键①断裂 |