题目内容
【题目】NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863 计划。
(1)催化剂常具有较强的选择性。已知:
反应I:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) △H1=-905kJ·mol-1
4NO(g)+6H2O(g) △H1=-905kJ·mol-1
反应II:4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) △H2=-1266.6kJ·mol-1
2N2(g)+6H2O(g) △H2=-1266.6kJ·mol-1
写出NO 分解生成N2与O2的热化学方程式______________________________________。
(2)N2O也可分解生成N2与O2。在四个恒容密闭容器中按左下表相应量充入气体,发生2N2O(g)![]() 2N2(g)+O2(g),容器I、II、III中N2O平衡转化率如下图所示。
2N2(g)+O2(g),容器I、II、III中N2O平衡转化率如下图所示。
容器 | 容积/L | 起始物质的量/mol | ||
N2O | N2 | O2 | ||
I | V1 | 0.1 | 0 | 0 |
II | 1.0 | 0.1 | 0 | 0 |
III | V2 | 0.1 | 0 | 0 |
IV | 1.0 | 0.06 | 0.06 | 0.04 |
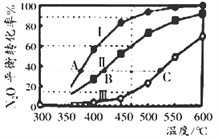
①该反应的△H_________0(填“>”、“=”、“<”);
②图中A、B、C 三点处容器内的总压强,由大到小的顺序是_____________________;
③容器IV在470℃进行反应时,起始速率:v(N2O)正____v (N2O)逆(填“>”、“=”、“<”)。
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在20L密闭容器中充lmolNH3和2molO2,测得一定时间内有关物质的量关系如图:
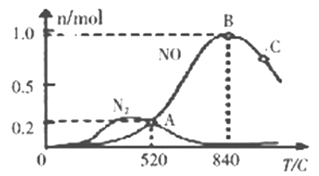
①该催化剂在低温时选择反应________(填“I”或“II”)。
②C点比B点所产生的NO的物质的量少的原因可能是_________________________________。
【答案】 2NO(g) ![]() N2(g)+O2(g)△H=-180.8kJ/mol > P(C)>P(B)>P(A)或C>B>A > II 该反应为放热反应,温度升高,平衡向逆反应方向移动 催化剂活性降低
N2(g)+O2(g)△H=-180.8kJ/mol > P(C)>P(B)>P(A)或C>B>A > II 该反应为放热反应,温度升高,平衡向逆反应方向移动 催化剂活性降低
【解析】(1) NO分解生成N2与O2的方程式为:2NO(g) ![]() N2(g)+O2(g),根据已知的反应I和反应II,要得到该方程,则:
N2(g)+O2(g),根据已知的反应I和反应II,要得到该方程,则:![]() ,则△H=
,则△H=![]() =
=![]() = -180.8kJ/mol,故答案为:2NO(g)
= -180.8kJ/mol,故答案为:2NO(g) ![]() N2(g)+O2(g) △H=-180.8kJ/mol
N2(g)+O2(g) △H=-180.8kJ/mol
(2) ①根据图像,温度升高,转化率增大,则平衡向右移动,说明正向吸热,则反应的△H >0;
②A、B、C三点中N2O的转化率相同,则容器中反应物生成物的量均相同,则容器的压强取决于容器的体积,根据图像,相同温度时:转化率大小为:I>II>III,则反应正向进行的程度为:I>II>III,且该反应为气体分子数增加的反应,增大容器体积,减小压强平衡向右移动,则说明容器体积大小为:I>II>III,故A、B、C三点处容器内的总压强由大到小的顺序是P(C)>P(B)>P(A);
③Ⅱ中在470℃下达到平衡时N2O的转化率是0.6,则该反应在470℃下平衡常数是![]() ,容器Ⅳ在470℃进行反应时,浓度熵=
,容器Ⅳ在470℃进行反应时,浓度熵=![]() <0.0675,所以反应向正反应方向进行,则起始速率:v(N2O)正>v(N2O)逆;
<0.0675,所以反应向正反应方向进行,则起始速率:v(N2O)正>v(N2O)逆;
(3) ①根据图像,在低温时,N2的量相对多一些,而N2是反应II的生成物,故该催化剂在低温时选择反应II;
②C点比B点所产生的NO的物质的量少的原因可能是平衡的逆向移动等原因。根据图像,该催化剂在高温时选择反应I,而反应I为放热反应,达到平衡后,温度升高平衡向左移动,使得C点比B点所产生的NO的物质的量少;或者可能使由于温度升高催化剂失去了活性等原因。

【题目】滴定实验是化学学科中重要的定量实验. 已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下实验:
①称量1.0g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用0.1000mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如表:
滴定序号 | 待测液体积(mL) | 所消耗标准盐酸的体积(mL) | |
滴定前 | 滴定后 | ||
① | 25.00 | 0.50 | 20.60 |
② | 25.00 | 6.00 | 26.00 |
③ | 25.00 | 1.10 | 21.00 |
请回答下列问题:
(1)滴定终点时的现象是 .
(2)所配制的250mL样品液中NaOH的物质的量浓度是 molL﹣1;试样中NaOH的质量分数为 .
(3)若出现下列情况,测定结果偏高的是 . a.滴定前用蒸馏水冲洗锥形瓶
b.在摇动锥形瓶时不慎将瓶内溶液溅出
c.滴定前有气泡,滴定后气泡消失
d.酸式滴定管滴至终点对,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗.
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表:下列说法错误的是( )
物质 | X | Y | Z |
初始浓度/molL﹣1 | 0.1 | 0.2 | 0 |
平衡浓度/molL﹣1 | 0.05 | 0.05 | 0.1 |
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y2Z
C.改变温度可以改变此反应的平衡常数
D.增大压强使平衡向生成Z的方向移动,平衡常数增大