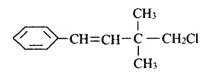题目内容
【题目】根据问题填空:
(1)已知在一定温度下,以下三个反应的平衡常数分别为K1、K2、K3: C(s)+CO2(g)2CO(g) K1
CO(g)+H2O(g)CO2(g)+H2(g) K2
C(s)+H2O(g)CO(g)+H2(g) K3
则K1、K2、K3之间的关系是K3=
(2)25℃时将pH=3的强酸与pH=12的强碱溶液混合,所得溶液pH=10,则强酸与强碱的体积比是(溶液混合时体积变化忽略不计) .
【答案】
(1)K1×K2
(2)9:1
【解析】解:(1)由①C(s)+CO2(g)2CO(g) K1
②CO(g)+H2O(g)CO2(g)+H2(g) K2
结合盖斯定律可知,①+②得到C(s)+H2O(g)CO(g)+H2(g),则K3=K1×K2,
所以答案是:K1×K2;(2)25℃时Kw=10﹣14,溶液pH=10,可知碱过量,设酸的体积为x,强碱体积为y,则 ![]() =10﹣4mol/L,
=10﹣4mol/L,
解得x:y=9:1,
所以答案是:9:1.
【考点精析】认真审题,首先需要了解化学平衡的计算(反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%).

 名校课堂系列答案
名校课堂系列答案【题目】NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863 计划。
(1)催化剂常具有较强的选择性。已知:
反应I:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) △H1=-905kJ·mol-1
4NO(g)+6H2O(g) △H1=-905kJ·mol-1
反应II:4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) △H2=-1266.6kJ·mol-1
2N2(g)+6H2O(g) △H2=-1266.6kJ·mol-1
写出NO 分解生成N2与O2的热化学方程式______________________________________。
(2)N2O也可分解生成N2与O2。在四个恒容密闭容器中按左下表相应量充入气体,发生2N2O(g)![]() 2N2(g)+O2(g),容器I、II、III中N2O平衡转化率如下图所示。
2N2(g)+O2(g),容器I、II、III中N2O平衡转化率如下图所示。
容器 | 容积/L | 起始物质的量/mol | ||
N2O | N2 | O2 | ||
I | V1 | 0.1 | 0 | 0 |
II | 1.0 | 0.1 | 0 | 0 |
III | V2 | 0.1 | 0 | 0 |
IV | 1.0 | 0.06 | 0.06 | 0.04 |
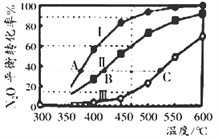
①该反应的△H_________0(填“>”、“=”、“<”);
②图中A、B、C 三点处容器内的总压强,由大到小的顺序是_____________________;
③容器IV在470℃进行反应时,起始速率:v(N2O)正____v (N2O)逆(填“>”、“=”、“<”)。
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在20L密闭容器中充lmolNH3和2molO2,测得一定时间内有关物质的量关系如图:
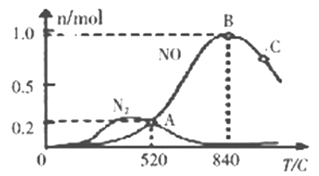
①该催化剂在低温时选择反应________(填“I”或“II”)。
②C点比B点所产生的NO的物质的量少的原因可能是_________________________________。
【题目】科学家在利用无土栽培法培养一些名贵花卉时,培养液中添加了多种必需化学元素,其配方如下:
离子 | K+ | Na+ | Mg2+ | Ca2+ | NO3- | H2PO42- | SO42- | Zn2+ |
培养液浓度( g/L ) | 1 | 1 | 0.25 | 1 | 2 | 1 | 0.25 | 1 |
其中花卉根细胞吸收最少的离子是
A.Ca2+B.SO42-C.Zn2+D.H2PO42-