题目内容
【题目】25℃时,用0.10mol/L的盐酸分别滴定体积相同且浓度均为0.10mol/L的三种一元碱XOH、YOH及ZOH,滴定曲线如图所示。

下列说法正确的是
A. 滴定XOH时可用酚酞作指示剂
B. YOH是强碱
C. X++H2O![]() XOH+H+的平衡常数K=10-4
XOH+H+的平衡常数K=10-4
D. [V(盐酸)/V(碱)]=0.5时,c(Z+)>c(Y+)>c(X+)
【答案】A
【解析】根据图像,0.10mol/L的三种一元碱XOH、YOH及ZOH的pH只有XOH的为13,因此XOH为强碱,其余为弱碱,且碱性XOH>YOH>ZOH。A. 强酸滴定强碱,最终溶液的pH=7 ,可用酚酞作指示剂,故A正确;B.根据上述分析, YOH是弱碱,故B错误;C. 根据上述分析,XOH为强碱X+不水解,故C错误;D. [V(盐酸)/V(碱)]=0.5时,溶液中存在等浓度的碱和盐,XOH为强碱完全电离,且X+不水解,因此c(X+)最大,故D错误;故选A。

 巧学巧练系列答案
巧学巧练系列答案【题目】NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863 计划。
(1)催化剂常具有较强的选择性。已知:
反应I:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) △H1=-905kJ·mol-1
4NO(g)+6H2O(g) △H1=-905kJ·mol-1
反应II:4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) △H2=-1266.6kJ·mol-1
2N2(g)+6H2O(g) △H2=-1266.6kJ·mol-1
写出NO 分解生成N2与O2的热化学方程式______________________________________。
(2)N2O也可分解生成N2与O2。在四个恒容密闭容器中按左下表相应量充入气体,发生2N2O(g)![]() 2N2(g)+O2(g),容器I、II、III中N2O平衡转化率如下图所示。
2N2(g)+O2(g),容器I、II、III中N2O平衡转化率如下图所示。
容器 | 容积/L | 起始物质的量/mol | ||
N2O | N2 | O2 | ||
I | V1 | 0.1 | 0 | 0 |
II | 1.0 | 0.1 | 0 | 0 |
III | V2 | 0.1 | 0 | 0 |
IV | 1.0 | 0.06 | 0.06 | 0.04 |
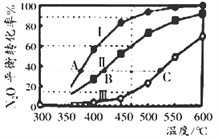
①该反应的△H_________0(填“>”、“=”、“<”);
②图中A、B、C 三点处容器内的总压强,由大到小的顺序是_____________________;
③容器IV在470℃进行反应时,起始速率:v(N2O)正____v (N2O)逆(填“>”、“=”、“<”)。
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在20L密闭容器中充lmolNH3和2molO2,测得一定时间内有关物质的量关系如图:
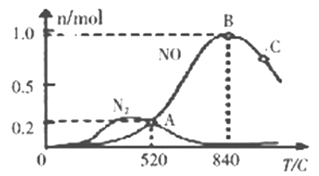
①该催化剂在低温时选择反应________(填“I”或“II”)。
②C点比B点所产生的NO的物质的量少的原因可能是_________________________________。