题目内容
【题目】水合肼(N2H4·H2O)是一种无色易溶于水的油状液体,具有碱性和极强的还原性,在工业生产中应用非常广泛。
(1)肼(N2H4)是一种火箭燃料。已知:
N2(g)+2O2(g)=2NO2(g); △H=+67.7 kJ·mol-1
N2H4(g)+O(g)=N2(g)+2H2O(g); △H=-534.0 kJ·mol-1
NO2(g)=![]() N2O4(g); △H=-28.0 kJ·mol-1
N2O4(g); △H=-28.0 kJ·mol-1
反应2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)的△H=________kJ·mol-1。
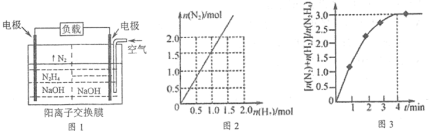
(2)目前正在研发的高能量密度燃料电池车是以水合肼燃料电池作为动力来源,电池结构如图1所示。
①起始时正极区与负极区NaOH溶液浓度相同,工作一段时间后,NaOH浓度较大的是___(填“正”或“负”)极区。
②该电池负极的电极反应式为_____________。
(3)已知水合肼是二元弱碱(25℃,K1=5×10-7,K2=5×10-15),0.1 mol·L-1水合肼溶液中四种离子:①H+、②OH-、③![]() 、④
、④![]() 的浓度从大到小的顺序为_________(填序号)。
的浓度从大到小的顺序为_________(填序号)。
(4)在弱酸性条件下水合肼可处理电镀废水,将![]() 还原为Cr(OH)3沉淀而除去,水合肼被氧化为N2,该反应的离子方程式为___________________。
还原为Cr(OH)3沉淀而除去,水合肼被氧化为N2,该反应的离子方程式为___________________。
(5)肼是一种优良的贮氢材料,其在不同条件下分解方式不同。
①在高温下,N2H4可完全分解为NH3、N2及H2,实验测得分解产物中N2与H2物质的量变化如图2所示,该分解反应方程式为__________________。
②在303K,NiPt催化下,则发生N2H4(l)![]() N2(g)+2H2(g)。在2L密闭容器中加入1 mol N2H4,测得容器中
N2(g)+2H2(g)。在2L密闭容器中加入1 mol N2H4,测得容器中![]() 与时间关系如图3所示。则0~4 min氮气的平均速率v(N2)=____________。
与时间关系如图3所示。则0~4 min氮气的平均速率v(N2)=____________。
【答案】-1079.7 正 N2H4+4OH--4e-=N2↑+4H2O ②③④① 2![]() +4H++3N2H4·H2O=4Cr(OH)3↓+3N2↑+5H2O 7N2H4(g)
+4H++3N2H4·H2O=4Cr(OH)3↓+3N2↑+5H2O 7N2H4(g)![]() 8NH3(g)+3N2(g)+2H2(g) 0.0625mol·L-1·min-1
8NH3(g)+3N2(g)+2H2(g) 0.0625mol·L-1·min-1
【解析】
(1)已知a.N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol,
b.N2H4(g)+O(g)=N2(g)+2H2O(g) △H=-534.0kJ/mol,
c.NO2(g)=![]() N2O4(g) △H=-28.0 kJ·mol-1,
N2O4(g) △H=-28.0 kJ·mol-1,
由盖斯定律b×2-a-c×2得到:热化学方程式:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1079.7kJ/mol;
(2)①负极发生氧化反应,肼失电子和氢氧根离子反应生成氮气和水,电极反应式为N2H4+4OH--4e-=4H2O+N2↑,正极是氧气得电子发生还原反应,正极反应为:O2+2H2O+4e-=4OH-,根据电极反应式可知工作一段时间后,正极区NaOH浓度较大;
②负极发生氧化反应,肼失电子和氢氧根离子反应生成氮气和水,电极反应式为N2H4+4OH--4e-=4H2O+N2↑;
(3)水合肼是二元弱碱,分步电离:N2H4·H2O![]()
![]() +OHˉ、
+OHˉ、![]() ·H2O
·H2O![]()
![]() +OHˉ,第一步电离会抑制第二步电离,两步电离均产生氢氧根,所以离子的浓度大小为:c(OHˉ)>c(
+OHˉ,第一步电离会抑制第二步电离,两步电离均产生氢氧根,所以离子的浓度大小为:c(OHˉ)>c(![]() )>c(
)>c(![]() )>c(H+),即②③④①;
)>c(H+),即②③④①;
(4)N2H4·H2O被氧化成N2,每个N化合价升高2价,共升高4价;![]() 被还原为Cr(OH)3,每个Cr降低3价,共降低6价,所以二者系数比为3:2,再结合元素守恒可得离子方程式为2
被还原为Cr(OH)3,每个Cr降低3价,共降低6价,所以二者系数比为3:2,再结合元素守恒可得离子方程式为2![]() +4H++3N2H4·H2O=4Cr(OH)3↓+3N2↑+5H2O;
+4H++3N2H4·H2O=4Cr(OH)3↓+3N2↑+5H2O;
(5)①据图可知相同时间内△n(H2):△n(N2)=2:3,再结合元素守恒可得该分解反应方程式为:7N2H4(g)![]() 8NH3(g)+3N2(g)+2H2(g);
8NH3(g)+3N2(g)+2H2(g);
②设0~4 min△n(N2H4)=a mol,剩余的n(N2H4)=(1-a)mol根据方程式可知△n(H2)=2a mol,△n(N2)=a mol,则有![]() =3,解得a=0.5,所以0~4 min△n(N2)=0.5mol,容器体积为2L,所以v(N2)=
=3,解得a=0.5,所以0~4 min△n(N2)=0.5mol,容器体积为2L,所以v(N2)=![]() = 0.0625mol·L-1·min-1。
= 0.0625mol·L-1·min-1。

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案【题目】某厂废酸主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+ 。利用该废液制备过二硫酸铵[( NH4) 2S2O8]和TiO2的一种工艺流程如下:

已知:i.TiOSO4在热水中易水解生成H2TiO3,相关离子形成氢氧化物沉淀的pH范围如 下表:
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的pH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii. pH>7 时,Fe2+部分生成 Fe( Ⅱ)氨络离Fe(NH3)2]2+o
请回答下列问题:
(1)加入适量Fe的作用是________________ .
(2)生成TiO(OH)2的化学方程式为_______________ 。
(3)滤渣I、滤渣II均含有的物质的化学式为_____________ .
(4)加入H2O2的目的是除掉Fe( Ⅱ)氨络离子[Fe(NH3)2]2+,此过程中氧化剂与还原剂的物质的量之比理论上等于________ (填数值)。
(5)常温下,含硫微粒主要存在形式与pH的关系如下图所示。

用Pt电极电解饱和NH4HSO4溶液制备过二硫酸铵时,为满足在阳极放电的离子主要为 HSO4-,应调节阳极区溶液的pH范围在______之间,其电极反应式为____________ 。
(6)科研人员常用硫酸铁铵[NH4Fe(SO4)2]滴定法测定TiO2的纯度,其步骤为: 用足量酸溶解wg 二氧化钛样品,用铝粉做还原剂,过滤、洗涤,将滤液定容为100 mL,取 25.00 mL,以NH4SCN作指示剂,用标准硫酸铁铵溶液滴定至终点,反应原理为: Ti3++Fe3+=Ti4++Fe2+。
①判断滴定终点的方法:________________________ 。
②滴定终点时消耗c mol/L-1 NH4Fe(SO4)2溶液VmL,则TiO2纯度为___________(写岀相关字母表示的代数式)。