题目内容
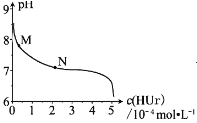
【题目】室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是

A. Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B. V(NaOH)=10.00 mL 时 >1
>1
C. pH=7时,两种酸所用NaOH溶液的体积相等
D. V(NaOH)=20.00 mL 时,c(Cl-)<c(CH3COO-)
【答案】B
【解析】
A、滴定开始时0.1000mol/L盐酸pH=1,0.1000mol/L醋酸pH>1,所以滴定盐酸的曲线是图Ⅱ,滴定醋酸的曲线是图Ⅰ,故A错误;
B、加入10mL氢氧化钠时,溶液中恰好为同浓度的醋酸和醋酸钠,醋酸电离大于醋酸根的水解程度,故 >1,故B正确;
>1,故B正确;
C、醋酸钠水解呈碱性,氯化钠不水解,pH=7时,醋酸所用NaOH溶液的体积小,故C错误;
D、V(NaOH)=20.00 mL 时,二者反应生成氯化钠和醋酸钠,醋酸根发生水解,浓度小于氯离子,故D错误.
答案选B。
【点晴】
本题考查NaOH与CH3COOH、盐酸的反应,涉及盐类的水解和溶液离子浓度的大小比较知识,注意利用醋酸电离大于醋酸根的水解程度做题。要学会根据滴定曲线和指示剂的发色范围选用指示剂:①0.1mol/L NaOH 滴定盐酸,酚酞和甲基橙均可使用,当然两者测定结果不同;②0.1mol/L NaOH溶液滴定0.1mol/L CH3COOH溶液,恰好中和生成CH3COONa,溶液呈弱碱性,选酚酞为指示剂,pH=8~10浅红色,误差小;③用HCl滴定NH3·H2O恰好中和生成NH4Cl,溶液呈弱酸性,选甲基橙为指示剂,3.1~4.4橙色,误差小;④用HCl滴定0.1mol/L Na2CO3溶液,第一步生成NaHCO3时,可选用酚酞为指示剂,由红色→浅红→无色,化学方程式为:Na2CO3+HCl═NaHCO3+NaOH;第二步生成碳酸(CO2↑+H2O),可选用甲基橙为指示剂,由黄色→橙色,化学方程式为:NaHCO3+HCl═NaCl+H2O+CO2↑。

【题目】下图中a、b分别是原电池的两极,接通电路后发现a极板质量增加,b极板溶解,符合这一情况的是( )
a极板 | b极板 | a电极 | Z溶液 | |
A | 锌 | 石墨 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 正极 | CuCl2 |
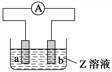
A. A B. B C. C D. D
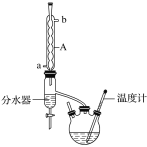
【题目】丁酸异戊酯又称香蕉油,多用于食品和化妆品的香精,实验室用正丁酸与异戊醇反应制备丁酸异戊酯,有关数据和装置示意图如下:
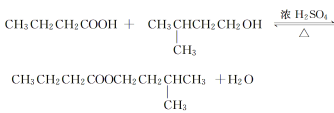
相对分子质量 | 密度(g·cm-3) | 沸点(℃) | 水中溶解性 | |
正丁酸 | 88 | 0.958 7 | 163.5 | 溶 |
异戊醇 | 88 | 0.813 2 | 131 | 微溶 |
丁酸异戊酯 | 158 | 0.886 | 179 | 不溶 |
实验步骤:
①如图连接好装置,在三颈烧瓶中加入0.2 mol异戊醇、0.1 mol正丁酸、数滴浓硫酸、5 mL苯和2~3片碎瓷片。充分摇匀,分水器内加入异戊醇直至与支管相平;
②在122~132℃下回流反应1.5h即可得粗产品;
③冷却后用10%的NaOH溶液中和用水洗至中性,加入无水硫酸镁后蒸馏得较纯净的丁酸异戊酯11g。
回答下列问题:
(1)图中A仪器的名称是___________。
(2)在该实验中,三颈烧瓶的容积最适合的是_____(填字母)。
A.50mL B.100mL C.200mL
(3)加入碎瓷片的作用是______;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是_____(填字母)。
A.冷却后补加 B.立即补加 C.不需补加 D.重新配料
(4)分离提纯过程中加入无水硫酸镁的目的是______________。
(5)在蒸馏得较纯净的丁酸异戊酯操作中,仪器选择及安装都正确的是_______(填字母)。

(6)本实验的产率是______(保留三位有效数字)。