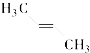题目内容
【题目】氨浸菱锌矿制备活性氧化锌,成本低,选择性好,其工艺流程如下:
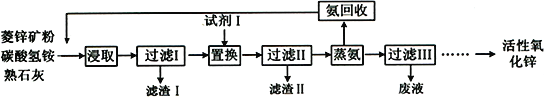
(1)滤渣Ⅰ主要成分的化学式为__________。
(2)浸取液中含少量Pb2+、Cu2+等重金属离子,可加入试剂Ⅰ除去,试剂Ⅰ为______________,但在实际操作过程中实际加入量远高于理论量,可能的原因是____________________________。
(3)过滤Ⅱ后得到Zn(NH3)4CO3溶液,经直接蒸汽加热可析出碱式碳酸锌[ZnCO3·2Zn(OH)2·H2O]沉淀,其反应化学方程式为____________________________。
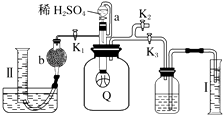
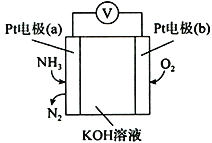
(4)蒸氨过程中会有部分氨气逸出,可用电化学气敏传感器监测环境中NH3的含量,原理如图所示。负极的电极反应为________________________________,假设蒸氨过程中逸出氨气16.8L (标准状况)进入传感器,另一极需要通入标准状况下O2的体积为____________________。
(5)蒸氨完成时,废液中残余氨含量需小于0.2mol/L,如果残余氨浓度过低,蒸汽用量增大,回收氨水中氨浓度降低,不利于循环使用;如果残余氨浓度过高,会导致____________________________。
【答案】 CaCO3 Zn 有副反应发生(或置换反应在固体表面进行,利用率不高) 3Zn(NH3)4CO3+3H2O![]() ZnCO3·2Zn(OH)2·H2O↓+12NH3↑+2CO2↑ 2NH3-6e-+6OH-=N2+6H2O 12.6L 残余锌浓度大,造成损失
ZnCO3·2Zn(OH)2·H2O↓+12NH3↑+2CO2↑ 2NH3-6e-+6OH-=N2+6H2O 12.6L 残余锌浓度大,造成损失
【解析】(1)菱锌矿粉、碳酸氢铵和熟石灰混合浸取后得到Zn(NH3)4CO3溶液和CaCO3沉淀等,通过过滤得到滤渣Ⅰ主要成分的化学式为CaCO3;(2)浸取液中含少量Pb2+、Cu2+等重金属离子,可加入试剂Ⅰ置换除去,故试剂Ⅰ为Zn;在实际操作过程中实际加入量远高于理论量,可能的原因是有副反应发生(或置换反应在固体表面进行,利用率不高);(3)过滤Ⅱ后得到Zn(NH3)4CO3溶液,经直接蒸汽加热可析出碱式碳酸锌[ZnCO3·2Zn(OH)2·H2O]沉淀,其反应化学方程式为3Zn(NH3)4CO3+3H2O![]() ZnCO3·2Zn(OH)2·H2O↓+12NH3↑+2CO2↑;(4)根据图中信息,a电极上氨气中氮元素得电子生成氮气,作为负极,负极反应式为:2NH3-6e-+6OH-=N2+6H2O;b电极为正极,氧气得电子被还原,电极总反应式为:4NH3+3O2=2N2+6H2O,根据反应可知,假设蒸氨过程中逸出氨气16.8L (标准状况)进入传感器,另一极需要通入标准状况下O2的体积为16.8L×
ZnCO3·2Zn(OH)2·H2O↓+12NH3↑+2CO2↑;(4)根据图中信息,a电极上氨气中氮元素得电子生成氮气,作为负极,负极反应式为:2NH3-6e-+6OH-=N2+6H2O;b电极为正极,氧气得电子被还原,电极总反应式为:4NH3+3O2=2N2+6H2O,根据反应可知,假设蒸氨过程中逸出氨气16.8L (标准状况)进入传感器,另一极需要通入标准状况下O2的体积为16.8L×![]() = 12.6L;(5)蒸氨完成时,废液中残余氨含量需小于0.2mol/L,如果残余氨浓度过低,蒸汽用量增大,回收氨水中氨浓度降低,不利于循环使用;如果残余氨浓度过高,会导致残余锌浓度大,造成损失。
= 12.6L;(5)蒸氨完成时,废液中残余氨含量需小于0.2mol/L,如果残余氨浓度过低,蒸汽用量增大,回收氨水中氨浓度降低,不利于循环使用;如果残余氨浓度过高,会导致残余锌浓度大,造成损失。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】根据下表中的信息分析回答问题:
元素 | 元素或由元素组成的物质性质 |
A | 单质在自然界中硬度最大,燃烧产生的气体能使澄清石灰水变浑浊。 |
B | 原子最外层电子数是次外层电子数三倍 |
C | 金属焰色反应为黄色,与氧气燃烧生成淡黄色固体 |
D | 单质在空气中体积分数最大 |
E | 固体为淡黄色,燃烧产生气体有漂白性。 |
F | 相同条件下气体密度最小 |
(1)用电子式写出形成F2E的过程__________________;
(2)写出CBF物质的电子式______________;
(3)C2B2物质中存在化学键的类型是___________ ,1 molC2B2与足量AB2反应转移的电子数为_______;
(4)由B、C、E形成的简单离子半径由大到小的关系是______________(用离子符号表示)。
【题目】如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
X | Y | Z | |
① | Cu | CuO | Cu(OH)2 |
② | CH3CH2OH | CH3CHO | CH2═CH2 |
③ | Na2CO3 | NaOH | NaHCO3 |
④ | CaCO3 | CaO | Ca(OH)2 |
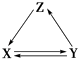
A.②③
B.③④
C.②④
D.①②