题目内容
X、Y、Z三种元素的原子,其最外层电子排布分别为ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是( )
| A.XYZ2 | B.X2YZ3 | C.X2YZ2 | D.XYZ3 |
A
解析试题分析:X原子最外层电子排布为ns1,处于第ⅠA族,化合价为+1,Y原子最外层电子排布为3s23p1,则Y为Al元素,Z原子最外层电子排布为2s22p4,则Z为氧元素,化合价为-2,A、XYZ2中Y的化合价为+3价,符合,如NaAlO2,故A正确;B、X2YZ3中Y的化合价为+4价,不符合,故B错误;C、X2YZ2中Y的化合价为+2价,不符合,故C错误;D、XYZ3中Y的化合价为+5价,不符合,故D错误;故选A。
考点:考查元素推断题,考查角度为根据原子核外电子排布特点推断元素种类,并判断可能的化合物

练习册系列答案
相关题目
下表为六种短周期元素的部分性质:
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.74 | 0.75 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
A.X与Y可以形成阴离子XY32-
B.元素R的氧化物对应水化物一定为强酸
C.Z的氢化物的沸点比T的氢化物的沸点高
D.由X形成的化合物QX和XR4,其晶体类型不相同
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是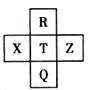
| A.非金属性:Z<T<X |
| B.R与Q的电子数相差26 |
| C.气态氢化物稳定性:R<T<Q |
| D.最高价氧化物的水化物的酸性:Q>T |
下列说法中正确的是
| A.只含有非金属元素的化合物可能是离子化合物 |
| B.第ⅠA族元素都比第ⅡA族元素金属性强 |
| C.只含有共价键的物质一定是共价化合物 |
| D.同主族元素原子半径越小越容易失去电子 |
对Na、Mg、Al的有关性质的叙述正确的是( )
| A.碱性:NaOH<Mg(OH)2<Al(OH)3 | B.第一电离能:Na<Mg<Al |
| C.电负性:Na>Mg>Al | D.还原性:Na>Mg>Al |
元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
| A.同周期元素中X的金属性最强 |
| B.同周期元素中Y的最高价含氧酸的酸性最强 |
| C.原子半径X>Y,离子半径X+>Z2- |
| D.同族元素中Z的氢化物稳定性最高 |
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )
| A.在自然界中只以化合态的形式存在 |
| B.单质常用作半导体材料和光导纤维 |
| C.最高价氧化物不与酸反应 |
| D.气态氢化物比甲烷稳定 |
下列顺序表述正确的是
| A.酸性:H3PO4> HNO3> HClO4 | B.稳定性:H2O > HF > H2S |
| C.原子半径:Na > Mg > O | D.还原性:F-> Cl-> S2- |
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是( )
| A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) |
| B.Y分别与Z、W形成的化合物中化学键类型相同 |
| C.X的最高价氧化物对应水化物的酸性比W的弱 |
| D.Y的气态简单氢化物的热稳定性比W的强 |