题目内容
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是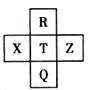
| A.非金属性:Z<T<X |
| B.R与Q的电子数相差26 |
| C.气态氢化物稳定性:R<T<Q |
| D.最高价氧化物的水化物的酸性:Q>T |
B
解析试题分析:根据“R单质在暗处与H2剧烈化合并发生爆炸”确定R为氟元素,再结合这些元素的位置关系,确定X为硫元素,T为氯元素,Z为氩元素,Q为溴元素。A项非金属性大小为Z<X<T ,错误;B项R(9)与Q(35)的电子数相差26,正确;C项气态氢化物稳定性为Q<T<R,错误;D项最高价氧化物的水化物的酸性大小为T>Q ,错误。
考点:考查元素周期表和元素周期律。

练习册系列答案
相关题目
放射性同位素钬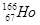 的原子核内的中子数与核外电子数之差是( )
的原子核内的中子数与核外电子数之差是( )
| A.32 | B.67 | C.99 | D.166 |
短周期元素X、Y、Z在周期表中位置如图。下列说法正确的是( )
| A.若它们均为金属元素,则X与氧元素组成的物质有多种 |
| B.若它们的原子最外层电子数之和为11,则它们均为非金属元素 |
| C.Z单质一定不能置换出Y单质。 |
| D.Z元素的最高化合价一定等于Y元素 |
已知同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为:HXO4>H2YO4>H3ZO4,则下列判断中正确的是( )
| A.元素非金属性按X、Y、Z的顺序减弱 |
| B.原子的电子能力按X、Y、Z的顺序增强 |
| C.气态氢化物的稳定性按X、Y、Z的顺序增强 |
| D.单质的氧化性按X、Y、Z的顺序增强 |
锗(Ge)是第四周期第 ⅣA 族元素,处于周期表中金属区与非金属区的交界线上,下列叙述正确的是
| A.锗是一种金属性很强的元素 |
| B.锗的单质具有半导体的性能 |
| C.锗化氢(GeH4)稳定性很强 |
| D.锗酸(H4GeO4)是难溶于水的强酸 |
下列气态氢化物最稳定的是
| A.HF | B.HCl | C.HBr | D.H2S |
已知X、Y是主族元素,I为电离能。请根据下表所列数据判断,错误的是
| I/kJ·mol-1 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
B.元素Y是ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应
X、Y、Z三种元素的原子,其最外层电子排布分别为ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是( )
| A.XYZ2 | B.X2YZ3 | C.X2YZ2 | D.XYZ3 |