题目内容
对Na、Mg、Al的有关性质的叙述正确的是( )
| A.碱性:NaOH<Mg(OH)2<Al(OH)3 | B.第一电离能:Na<Mg<Al |
| C.电负性:Na>Mg>Al | D.还原性:Na>Mg>Al |
D
解析试题分析:A、同周期元素从左到右,元素的金属性逐渐减弱,对应的最高价氧化物的水化物的碱性减弱,金属性:Na>Mg>Al,则碱性:NaOH>Mg(OH)2>Al(OH)3,故A错误;B、同周期元素从左到右,第一电离能逐渐增大,但Mg的最外层为全充满状态,电子能量最低,第一电离能:Mg>Al>Na,故B错误;C、同周期元素从左到右,元素的电负性逐渐增强,则电负性:Na<Mg<Al,故C不正确;D、同周期元素从左到右,元素的金属性逐渐减弱,对应单质的还原性逐渐减弱,还原性:Na>Mg>Al,故D正确,答案选D。
考点:考查同周期元素的性质的递变规律

练习册系列答案
相关题目
下列递变规律正确的是
| A.HClO4、H2SO4、H3PO4的酸性依次增强 |
| B.HCl、HBr 、HI的稳定性依次增强 |
| C.钠、镁、铝的还原性依次减弱 |
| D.N、O、F原子半径逐渐增大 |
锗(Ge)是第四周期第 ⅣA 族元素,处于周期表中金属区与非金属区的交界线上,下列叙述正确的是
| A.锗是一种金属性很强的元素 |
| B.锗的单质具有半导体的性能 |
| C.锗化氢(GeH4)稳定性很强 |
| D.锗酸(H4GeO4)是难溶于水的强酸 |
已知X、Y是主族元素,I为电离能。请根据下表所列数据判断,错误的是
| I/kJ·mol-1 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
B.元素Y是ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应
下列说法不能证明氯的非金属性比硫强的是
| A.HCl比H2S稳定 |
| B.HClO4的酸性比H2SO4的酸性强 |
| C.向Na2S溶液中通入Cl2,溶液变浑浊 |
| D.向新制氯水中滴加Na2SO3溶液,氯水褪色 |
X、Y、Z三种元素的原子,其最外层电子排布分别为ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是( )
| A.XYZ2 | B.X2YZ3 | C.X2YZ2 | D.XYZ3 |
在元素周期表中金属与非金属的分界处,可以找到( )
| A.合金 | B.半导体材料 | C.催化剂 | D.农药 |
关于下列各组物质的相互关系,判断正确的是( )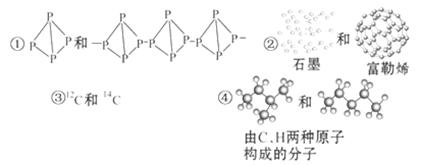

| A.互为同素异形体的是①② | B.互为同位素的是②③ |
| C.互为同一物质的是①⑤ | D.互为同分异构体的是④⑤ |
下列各组中的元素用原子序数表示,其中都属于主族的一组元素是( )
| A.2,4,6 | B.19,20,21 | C.1,3,5 | D.8,16,18 |