题目内容
 |
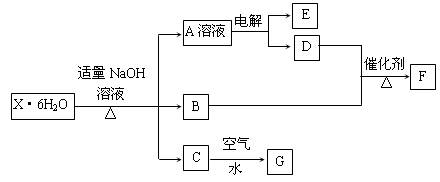
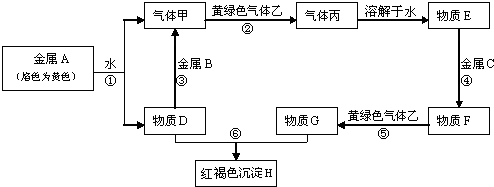
(12分)A、B、C、D、E、F、G、H、I、J均为中学化学中常见物质,其相互转化的关系如下所示:
已知,A的焰色反应呈黄色,I是一种红褐色沉淀。
(1)写出下列物质的化学式:B E D H 。
 (2)如果C是液态物质:①写出A的电极反应方程式:阴极 ;阳极 ;②写出H I的化学方程式 ;③G与足量Cl2反应的离子方程式 。
(2)如果C是液态物质:①写出A的电极反应方程式:阴极 ;阳极 ;②写出H I的化学方程式 ;③G与足量Cl2反应的离子方程式 。(1)NaOH,Fe,H2,Fe(OH)2
(2)①阴极:2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-);阳极:2Br--2e-=Br2
②4Fe(OH)2+O2+2H2O=4Fe(OH)3↓
③2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
(2)①阴极:2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-);阳极:2Br--2e-=Br2
②4Fe(OH)2+O2+2H2O=4Fe(OH)3↓
③2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
【分析预测及备考建议】无机框图题是高考的必考题型之一,它是以无机物之间的变化为载体,考查学生的分析能力、逻辑推理能力和信息加工能力。在复习中首先要将中学化学中常见物质的相互转化理清,经常进行将块状知识网络化的强化训练。这样在考题中就会抓好突破口,进行推理。
【答题技巧】在解决无机框图题时,一定要找到相应的突破口,本题中要注意到I是一种红褐色沉淀,对应到Fe(OH)3,从而可得H是Fe(OH)2,进一步可知B是一个碱而A中是含Na+的溶液,所以B为NaOH,则G为含Fe2+的溶液,在电解时被电解的是溶液中的水电离产生的H+,产物之一是H2,同时被电解的还有溶液中的阴离子,生成物为液体C,所以可得原溶液为NaBr溶液,从而可得D为H2,C为溴。由E、F、G含有Fe元素且F含Fe3+,G含Fe2+,则可知E为Fe单质。
【答题技巧】在解决无机框图题时,一定要找到相应的突破口,本题中要注意到I是一种红褐色沉淀,对应到Fe(OH)3,从而可得H是Fe(OH)2,进一步可知B是一个碱而A中是含Na+的溶液,所以B为NaOH,则G为含Fe2+的溶液,在电解时被电解的是溶液中的水电离产生的H+,产物之一是H2,同时被电解的还有溶液中的阴离子,生成物为液体C,所以可得原溶液为NaBr溶液,从而可得D为H2,C为溴。由E、F、G含有Fe元素且F含Fe3+,G含Fe2+,则可知E为Fe单质。

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目