题目内容
有M、A、B、D、E五种短周期元素,其原子序数依次增大,M元素的原子半径是周期表所有元素中最小的。A、B、D、E分别在下表中(周期表的一部分)不同的空格内占有相应的位置,它们的原子序数之和为37。请回答:
(1)元素符号:A B D E
(2)D、E两种元素分别与M元素形成的最简单化合物中,相对稳定的是 (填化学式),沸点较高的是 (填化学式)。
(3)A、B、D、M可组成多种18电子的分子,其中的两种结构可分别表示为M2B—BM2和
AM3—BM2,请再写出2种具有18电子的有机物的结构简式 、 。
(4)M、B、D以原子个数比4:2:3所形成的离子化合物,其水溶液呈 性。0.1mol/L该化合物的水溶液中各离子的浓度由大到小的排序是 。
| | | |
| | | |
(2)D、E两种元素分别与M元素形成的最简单化合物中,相对稳定的是 (填化学式),沸点较高的是 (填化学式)。
(3)A、B、D、M可组成多种18电子的分子,其中的两种结构可分别表示为M2B—BM2和
AM3—BM2,请再写出2种具有18电子的有机物的结构简式 、 。
(4)M、B、D以原子个数比4:2:3所形成的离子化合物,其水溶液呈 性。0.1mol/L该化合物的水溶液中各离子的浓度由大到小的排序是 。
(1)A:C B:N D:O E:S (2)H2O 、 H2O (3)CH3CH3 、CH3OH (4)酸
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
M是H元素,对于短周期的主族元素,上下周期的元素的原子序数相差为8,则有
 ,解得
,解得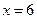 ,所以四种元素:A是C、B是N、D是O、E是S;(2)D和E事同主族元素,随着核电荷数的增加,非金属性在逐渐的减弱,则H2O的热稳定性强于H2S,沸点最高的也是水(分子间存在氢键);(3)根据18电子,我们可以写出CH3CH3、CH3OH等;(4)M、B、D以原子个数比4:2:3所形成的离子化合物是NH4NO3,因为是强酸弱碱盐,所以溶液呈酸性,根据酸性溶液中,可以写出c(NO3-)>c(NH4+)>c(H+)>c(OH-)。
,所以四种元素:A是C、B是N、D是O、E是S;(2)D和E事同主族元素,随着核电荷数的增加,非金属性在逐渐的减弱,则H2O的热稳定性强于H2S,沸点最高的也是水(分子间存在氢键);(3)根据18电子,我们可以写出CH3CH3、CH3OH等;(4)M、B、D以原子个数比4:2:3所形成的离子化合物是NH4NO3,因为是强酸弱碱盐,所以溶液呈酸性,根据酸性溶液中,可以写出c(NO3-)>c(NH4+)>c(H+)>c(OH-)。
 ,解得
,解得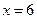 ,所以四种元素:A是C、B是N、D是O、E是S;(2)D和E事同主族元素,随着核电荷数的增加,非金属性在逐渐的减弱,则H2O的热稳定性强于H2S,沸点最高的也是水(分子间存在氢键);(3)根据18电子,我们可以写出CH3CH3、CH3OH等;(4)M、B、D以原子个数比4:2:3所形成的离子化合物是NH4NO3,因为是强酸弱碱盐,所以溶液呈酸性,根据酸性溶液中,可以写出c(NO3-)>c(NH4+)>c(H+)>c(OH-)。
,所以四种元素:A是C、B是N、D是O、E是S;(2)D和E事同主族元素,随着核电荷数的增加,非金属性在逐渐的减弱,则H2O的热稳定性强于H2S,沸点最高的也是水(分子间存在氢键);(3)根据18电子,我们可以写出CH3CH3、CH3OH等;(4)M、B、D以原子个数比4:2:3所形成的离子化合物是NH4NO3,因为是强酸弱碱盐,所以溶液呈酸性,根据酸性溶液中,可以写出c(NO3-)>c(NH4+)>c(H+)>c(OH-)。
练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
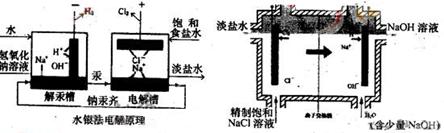

 C+D(若生成物中除C、D外还有水的话,则水被略去)
C+D(若生成物中除C、D外还有水的话,则水被略去)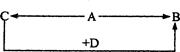

 (2)如果C是液态物质:①写出A的电极反应方程式:阴极 ;阳极 ;②写出H I的化学方程式 ;③G与足量Cl2反应的离子方程式 。
(2)如果C是液态物质:①写出A的电极反应方程式:阴极 ;阳极 ;②写出H I的化学方程式 ;③G与足量Cl2反应的离子方程式 。