题目内容
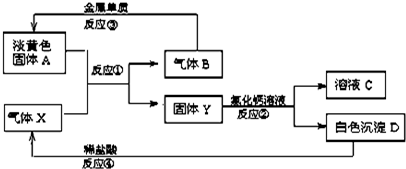
(10分)四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,
①它们的分子式分别是________、________;
②杂化轨道分别是________、________;
③a分子的立体结构是________;
(2)X的氧化物与Y的氧化物中,分子极性较小的是________;(填分子式)
(3)Y与Z比较,电负性较大的是________;(填元素名称)
(4)W的元素符号是________,其+2价离子的核外电子排布式是________。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,
①它们的分子式分别是________、________;
②杂化轨道分别是________、________;
③a分子的立体结构是________;
(2)X的氧化物与Y的氧化物中,分子极性较小的是________;(填分子式)
(3)Y与Z比较,电负性较大的是________;(填元素名称)
(4)W的元素符号是________,其+2价离子的核外电子排布式是________。
(10分,每空1分)(1)CH4 SiH4 sp3 sp3 正四面体
(2)CO2 (3)碳 (4)Zn 1s22s22p63s23p63d10(2分,其余每空1分)
(2)CO2 (3)碳 (4)Zn 1s22s22p63s23p63d10(2分,其余每空1分)
根据元素的结构及有关性质可知,X、Y、Z、W分别是H、C、Si、Zn.
(1)①碳和硅原子与氢原子形成的化合物分子式分别是CH4、SiH4。
②两种分子都正四面体结构,所以都是sp3杂化。
③甲烷是正四面体形结构。
(2)水是极性分子,CO2是非极性分子,所以分子极性较小的是CO2。
(3)非金属性越强,电负性越大,非金属性是碳大于硅,所以碳的非金属性大于硅的。
(4)W是锌,元素符号是Zn。根据构造原理可知,其+2价离子的核外电子排布式是1s22s22p63s23p63d10。
(1)①碳和硅原子与氢原子形成的化合物分子式分别是CH4、SiH4。
②两种分子都正四面体结构,所以都是sp3杂化。
③甲烷是正四面体形结构。
(2)水是极性分子,CO2是非极性分子,所以分子极性较小的是CO2。
(3)非金属性越强,电负性越大,非金属性是碳大于硅,所以碳的非金属性大于硅的。
(4)W是锌,元素符号是Zn。根据构造原理可知,其+2价离子的核外电子排布式是1s22s22p63s23p63d10。

练习册系列答案
相关题目

 (2)如果C是液态物质:①写出A的电极反应方程式:阴极 ;阳极 ;②写出H I的化学方程式 ;③G与足量Cl2反应的离子方程式 。
(2)如果C是液态物质:①写出A的电极反应方程式:阴极 ;阳极 ;②写出H I的化学方程式 ;③G与足量Cl2反应的离子方程式 。