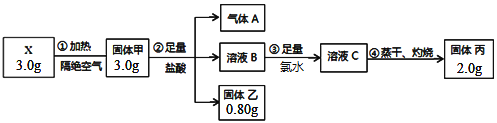
题目内容
【题目】粉煤灰(主要含有 SiO2、Fe2O3、Al2O3 等)是燃煤发电过程中产生的废渣,粉煤灰的综合利用具有 很大的价值。
Ⅰ.研究人员通过实验对粉煤灰中铝和铁元素的分离工艺进行了研究。
(1)以硫酸溶液分解粉煤灰,使其中的铝、铁元素溶出,过滤实现初步分离。
①写出硫酸溶液与 Fe2O3 反应的离子方程式_____。
②初步分离得到的滤渣主要成分是_____。
(2)向(1)分离所得的滤液中加入还原剂使 Fe3+转化为 Fe2+,结合下表分析其原因____。
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
沉淀区间(pH) | 7.06~8.95 | 1.94~3.20 | 3.69~4.8 |
(3)使用碱性较弱的氨水为pH调节剂,进行分离实验。
①氨水使滤液中铝离子沉淀的离子方程式为_____。
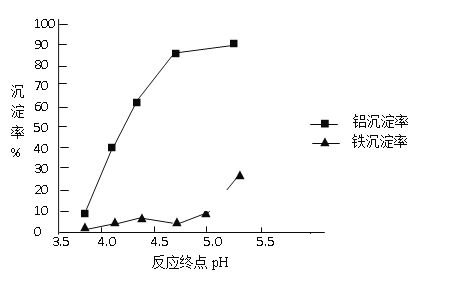
②反应终点的pH对铝和铁分离效果的影响如下图。根据实验结果,为达到好的分离效果,反应过程中控制pH的 范围是______________,选择该范围的理由是___________________。
Ⅱ.NH4HSO4和H2SO4按物质的量比1∶1混合配制成浸取液,220℃时,可将高铝粉煤灰中Al2O3转化为硫酸铝铵 [NH4Al(SO4)2],然后分离、煅烧获得纯Al2O3。 已知硫酸铝铵:①溶解度:0℃时,S=5.2g;100℃时,S=421.9g。②280℃时分解。
(1)依据资料可知,将硫酸铝铵与其他溶质分离的方法是_____。
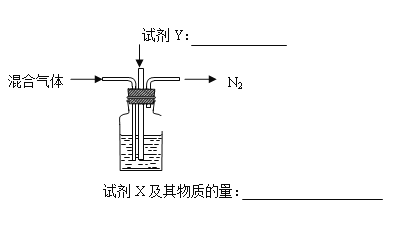
(2)煅烧 NH4Al(SO4)2 同时得到混合气体(NH3、N2、SO2、SO3、H2O)。若 16 mol 混合气体按如下装置被完全吸收制得浸取液,请将下图中试剂(化学式)及其物质的量补充完整。____________,___________
4NH4Al(SO4)2 ![]() 2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑
2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑
【答案】6H++Fe2O3![]() 2Fe3++3H2OSiO2Fe(OH)3和Al(OH)3沉淀的pH相近,不易通过沉淀分离3NH3·H2O+Al3+
2Fe3++3H2OSiO2Fe(OH)3和Al(OH)3沉淀的pH相近,不易通过沉淀分离3NH3·H2O+Al3+![]() Al(OH)3↓+3NH4+略小于5铝元素沉淀较多,铁元素还没有开始大量的沉淀冷却、结晶试剂Y:O2试剂X及其物质的量:含2mol溶质的氨水
Al(OH)3↓+3NH4+略小于5铝元素沉淀较多,铁元素还没有开始大量的沉淀冷却、结晶试剂Y:O2试剂X及其物质的量:含2mol溶质的氨水
【解析】
Ⅰ.(1)①硫酸与氧化铁反应生成硫酸铁和水,离子方程式为:6H++Fe2O3![]() 2Fe3++3H2O;综上所述,本题答案是:6H++Fe2O3
2Fe3++3H2O;综上所述,本题答案是:6H++Fe2O3![]() 2Fe3++3H2O。
2Fe3++3H2O。
②硫酸将氧化铁和氧化铝溶解,生成铁离子和铝离子,二氧化硅不与硫酸反应,初步分离得到的滤渣主要成分是SiO2;综上所述,本题答案是:SiO2。
(2)Fe(OH)3和Al(OH)3沉淀的pH相近,不易通过沉淀分离,将Fe3+转化为Fe2+后,Fe(OH)2的沉淀pH与Al(OH)3相差较大,便于分离;综上所述,本题答案是:Fe(OH)3和Al(OH)3沉淀的pH相近,不易通过沉淀分离。
(3)①一水合氨是弱碱,与铝离子反应生成氢氧化铝沉淀,反应的离子方程式为:3NH3·H2O+Al3+![]() Al(OH)3↓+3NH4+;综上所述,本题答案是:3NH3·H2O+Al3+
Al(OH)3↓+3NH4+;综上所述,本题答案是:3NH3·H2O+Al3+![]() Al(OH)3↓+3NH4+。
Al(OH)3↓+3NH4+。
②由图可知:pH略小于5时,Al的沉淀率较高(接近90%),而Fe的沉淀率较低(小于10%),当pH大于5时,Fe的沉淀率突然增大,且Al的沉淀率无明显变化,所以反应过程中控制pH略小于5;综上所述,本题答案是:略小于5,铝元素沉淀较多,铁元素还没有开始大量的沉淀。
Ⅱ.(1)根据NH4Al(SO4)2 在0℃和100℃时溶解度变化可知NH4Al(SO4)2 的溶解度受温度影响较大,温度较低时溶解度较低,选用冷却、结晶的方法将NH4Al(SO4)2 与其他溶质分离;综上所述,本题答案是:冷却、结晶。
(2)根据已知可知浸取液中硫元素的存在形式为SO42-;由图可知最终排放的气体只有N2,则其他气体均被吸收,且硫元素最终转化为SO42-,把SO2氧化为SO42-,所以气体Y是O2;根据化合价升降守恒,煅烧NH4Al(SO4)2 的化学方程式为: 4NH4Al(SO4)2 ![]() 2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑;据以上反应可知4mol NH4Al(SO4)2煅烧生成16mol气体,其中3molSO2 、5molSO3溶于水后,经过氧气氧化,最终溶液中含有8mol SO42-;2molNH3通入瓶中,最终转化为2molNH4+,又因为NH4HSO4和H2SO4按照物质的量比1:1配成浸取液,根据SO42-的物质的量可知,共需要4molNH4HSO4,除去氨气转化生成的2molNH4+,还需要2molNH4+,因此加入的试剂X是含2mol溶质的氨水;综上所述,本题答案是:试剂Y:O2;试剂X及其物质的量:含2mol溶质的氨水。
2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑;据以上反应可知4mol NH4Al(SO4)2煅烧生成16mol气体,其中3molSO2 、5molSO3溶于水后,经过氧气氧化,最终溶液中含有8mol SO42-;2molNH3通入瓶中,最终转化为2molNH4+,又因为NH4HSO4和H2SO4按照物质的量比1:1配成浸取液,根据SO42-的物质的量可知,共需要4molNH4HSO4,除去氨气转化生成的2molNH4+,还需要2molNH4+,因此加入的试剂X是含2mol溶质的氨水;综上所述,本题答案是:试剂Y:O2;试剂X及其物质的量:含2mol溶质的氨水。