��Ŀ����
����Ŀ���������ӷ���ʽ����ȷ����
A. FeBr2��Һ�м�������ʵ�����Cl2��2Fe2+ + 2Br�� + 2Cl2 = 2Fe3++Br2+4Cl��
B. ��������ڲ���������������SiO2 + 4H+ + 4F�� = SiF4��+ 2H2O
C. ��ͭ˿Ͷ��ϡ�����У�Cu + 4H+ + 2NO3���� Cu2+ + 2NO2��+ 2H2O
D. NaOH��NH4Cl��Һ��ϼ��ȣ�NH4+ + OH�� ![]() NH3��H2O
NH3��H2O
���𰸡�A
��������A��FeBr2��Һ�м�������ʵ�����Cl2��Ӧ�����Ȼ������壻B��HF����������C��ϡ���ᱻ��ԭ��Ӧ��ԭ����ΪNO��D���������ƺ��Ȼ����Һ��ϼ������ɰ������ݴ˷����жϡ�
A��FeBr2��Һ�м�������ʵ�����Cl2��Ӧ�����Ȼ������壬���ӷ���ʽΪ2Fe2+ + 2Br�� + 2Cl2 = 2Fe3++Br2+4Cl������A��ȷ��B�������������ʴ���������ӷ�ӦΪSiO2+4HF�TSiF4��+2H2O����B����C����ͭ˿Ͷ��ϡ�����У����ӷ���ʽΪ��3Cu+8H++2NO3-=3Cu2++2NO��+4H2O����C����D���������ƺ��Ȼ����Һ��ϼ������ɰ��������ӷ���ʽΪNH4++OH- ![]() NH3��+H2O����D����ѡA��
NH3��+H2O����D����ѡA��
���磺���⿼�������ӷ���ʽ�������жϡ�ע�����ӷ���ʽ�����жϳ��÷�������鷴Ӧ�ܷ�������鷴Ӧ��������Ƿ���ȷ���������ʲ���Ƿ���ȷ������Ƿ�����غ��ϵ�ȡ�������״���ΪA��Ҫע�����ʵ�����Ĺ�ϵ��

����Ŀ����ú������Ҫ���� SiO2��Fe2O3��Al2O3 ������ȼú��������в����ķ�������ú�ҵ��ۺ����þ��� �ܴ�ļ�ֵ��
���о���Աͨ��ʵ��Է�ú����������Ԫ�صķ��빤�ս������о���
��1����������Һ�ֽ��ú�ң�ʹ���е�������Ԫ���ܳ�������ʵ�ֳ���������
��д��������Һ�� Fe2O3 ��Ӧ�����ӷ���ʽ_____��
����������õ���������Ҫ�ɷ���_____��
��2������1���������õ���Һ�м��뻹ԭ��ʹ Fe3+ת��Ϊ Fe2+������±�������ԭ��____��
���� | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
����������pH�� | 7.06~8.95 | 1.94~3.20 | 3.69~4.8 |
��3��ʹ�ü��Խ����İ�ˮΪpH���ڼ������з���ʵ�顣
�ٰ�ˮʹ��Һ�������ӳ��������ӷ���ʽΪ_____��
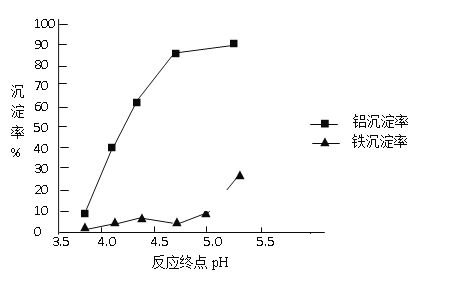
�ڷ�Ӧ�յ��pH������������Ч����Ӱ������ͼ������ʵ������Ϊ�ﵽ�õķ���Ч������Ӧ�����п���pH�� ��Χ��______________��ѡ��÷�Χ��������___________________��
��NH4HSO4��H2SO4�����ʵ�����1��1������Ƴɽ�ȡҺ��220��ʱ���ɽ�������ú����Al2O3ת��Ϊ������� [NH4Al(SO4)2]��Ȼ����롢���ջ�ô�Al2O3�� ��֪������������ܽ����0��ʱ��S��5.2g��100��ʱ��S��421.9g����280��ʱ�ֽ���
��1���������Ͽ�֪��������������������ʷ���ķ�����_____��
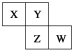
��2������ NH4Al(SO4)2 ͬʱ�õ�������壨NH3��N2��SO2��SO3��H2O������ 16 mol ������尴����װ�ñ���ȫ�����Ƶý�ȡҺ���뽫��ͼ���Լ�����ѧʽ���������ʵ�������������____________��___________
4NH4Al��SO4��2 ![]() 2Al2O3+5SO3��+3SO2��+2NH3��+N2��+5H2O��
2Al2O3+5SO3��+3SO2��+2NH3��+N2��+5H2O��