题目内容
【题目】化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 kJ。该反应的热化学方程式为__________________________。
(2)反应AX3(g)+X2(g)![]() AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
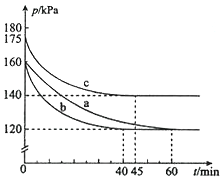
①实验a从反应开始至达到平衡时的反应速率v(AX5)=________(保留两位有效数字)。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为___________ (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:
b____________________、c____________________。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为__________________。
【答案】AX3(l)+X2(g)![]() AX5(s) ΔH=-123.8 kJ/mol0. 00017(或1.7×10-4 mol·L-1·min-1)bca加入催化剂,反应速率加快,但平衡没有改变温度升高,反应速率加快,但平衡向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大)2(1-
AX5(s) ΔH=-123.8 kJ/mol0. 00017(或1.7×10-4 mol·L-1·min-1)bca加入催化剂,反应速率加快,但平衡没有改变温度升高,反应速率加快,但平衡向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大)2(1-![]() )
)
【解析】
(1) 因为AX3的熔点和沸点分别为-93.6℃和76℃,AX5的熔点为167℃,室温时,AX3为液态,AX5为固态,生成1molAX5,放出热量123.8kJ,该反应的热化学方程为:AX3(l)+X2(g)=AX5(s)△H=-123.8kJmol-1,因此,本题正确答案是:AX3(l)+X2(g)=AX5(s)△H=-123.8kJmol-1;
(2) ①起始时AX3和X2均为0.2mol,即no=0.4mol,总压强为160KPa,平衡时总压强为120KPa,设平衡时总物质的量为n,根据压强之比就等于物质的量之比有 n=0.30mol。根据反应进行如下计算: 设生成AX5的量为x,
AX3(l) + X2(g)= AX5(s)
初始 (mol) 0.20 0.20 0
平衡 (mol) 0.20-x 0.20-x x
(0.20-x)+(0.20-x)+x=0.30,则x=0.10,所以实验a从反应开始至达到平衡时的反应速率v(AX5)=0.10/(10×60)=0.00017 mol·L-1·min-1)综上所述,本题答案是:0.00017(或1.7×10-4 mol·L-1·min-1)。
②根据到abc达平衡用时的多少可以比较出反应速率的大小为:b>c>a;对于曲线b,加入催化剂,反应速率加快,但平衡没有改变,压强保持不变;对于曲线c,温度升高,反应速率加快,但平衡向逆反应方向移动,压强增大(或反应容器的容积和起始物质的量未改变,但起始总压强增大) ;综上所述,本题答案是:bca;加入催化剂,反应速率加快,但平衡没有改变 ;度升高,反应速率加快,但平衡向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大) 。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,根据压强之比等于物质的量之比有: p0/p=0.4/n, n=0.4×p/p0 ,据反应进行如下计算:
AX3(l) + X2(g)= AX5(s)
初始 (mol) 0.20 0.20 0
平衡 (mol) 0.20-x 0.20-x x
(0.20-x)+(0.20-x)+x=n,x=0.4-n=0.4-0.4×p/p0 = 2(1-![]() );综上所述,本题答案是:2(1-
);综上所述,本题答案是:2(1-![]() )。
)。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案【题目】粉煤灰(主要含有 SiO2、Fe2O3、Al2O3 等)是燃煤发电过程中产生的废渣,粉煤灰的综合利用具有 很大的价值。
Ⅰ.研究人员通过实验对粉煤灰中铝和铁元素的分离工艺进行了研究。
(1)以硫酸溶液分解粉煤灰,使其中的铝、铁元素溶出,过滤实现初步分离。
①写出硫酸溶液与 Fe2O3 反应的离子方程式_____。
②初步分离得到的滤渣主要成分是_____。
(2)向(1)分离所得的滤液中加入还原剂使 Fe3+转化为 Fe2+,结合下表分析其原因____。
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
沉淀区间(pH) | 7.06~8.95 | 1.94~3.20 | 3.69~4.8 |
(3)使用碱性较弱的氨水为pH调节剂,进行分离实验。
①氨水使滤液中铝离子沉淀的离子方程式为_____。
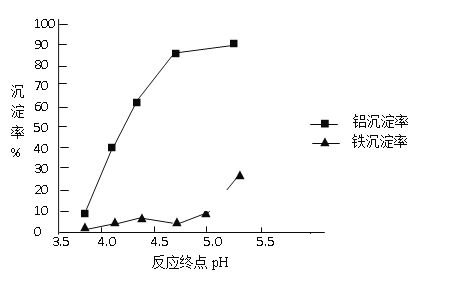
②反应终点的pH对铝和铁分离效果的影响如下图。根据实验结果,为达到好的分离效果,反应过程中控制pH的 范围是______________,选择该范围的理由是___________________。
Ⅱ.NH4HSO4和H2SO4按物质的量比1∶1混合配制成浸取液,220℃时,可将高铝粉煤灰中Al2O3转化为硫酸铝铵 [NH4Al(SO4)2],然后分离、煅烧获得纯Al2O3。 已知硫酸铝铵:①溶解度:0℃时,S=5.2g;100℃时,S=421.9g。②280℃时分解。
(1)依据资料可知,将硫酸铝铵与其他溶质分离的方法是_____。
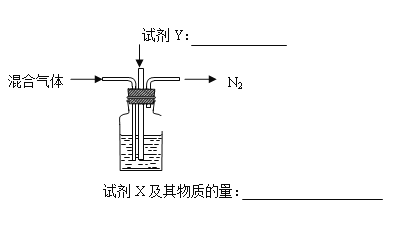
(2)煅烧 NH4Al(SO4)2 同时得到混合气体(NH3、N2、SO2、SO3、H2O)。若 16 mol 混合气体按如下装置被完全吸收制得浸取液,请将下图中试剂(化学式)及其物质的量补充完整。____________,___________
4NH4Al(SO4)2 ![]() 2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑
2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑